I. 서 론
세계보건기구(WHO)에 따르면 1980년에는 1억 800만 명이었던 당뇨병 환자의 수가 2014년에는 4억 2,200만 명으로 증가하였다. 시간이 지남에 따라 당뇨병은 심장, 눈, 신장 및 신경의 혈관을 손상시킬 수 있으며, 당뇨병 환자들은 심근경색, 뇌졸중 및 신부전과 같은 건강 문제 위험이 더 높다. 이로 인해 2000년부터 2019년까지 연령별 당뇨병 사망률은 3 % 증가하였으며, 2019년에는 당뇨병과 당뇨병으로 인한 신장 질환으로 약 200만 명이 사망하였다[1]. 당뇨병 환자의 경우 자신의 혈당 변화의 흐름을 파악하여 목표 혈당을 유지하기 위해 식사 전 및 취침 전 등 최소 2번 이상 혈당을 측정해야 한다[2]. 혈당을 측정하기 위한 방법으로는 침습 방법과 비침습 방법이 있다. 혈당 모니터링을 위한 전통적인 침습 센서들은 침습 방법이며 전기화학적인 방법을 사용하는데, 이는 손가락을 찌르거나 피하에 얇은 랜셋을 삽입하여 혈액을 추출해야 한다. 이 방법들은 반복적인 사용으로 인해 불편함과 통증을 유발할 뿐만 아니라 잠재적인 감염과 조직 손상의 위험을 가지고 있어 당뇨병 환자들이 지속적으로 자신의 혈당을 모니터링하는 것을 어렵게 한다[3]. 이런 문제들을 해결하기 위해 최근 몇십 년간 비침습 혈당 센서를 위한 여러 분야에서의 연구가 활발히 진행 중이며[4]~[6], 그중에서도 광학 분광법, 광음향 분광법, 전자기 센싱, 나노물질 기반 센싱 등에 대한 연구가 가장 폭넓게 연구되고 있다[7]. 광학 분광법의 종류는 다양하지만, 그중에서도 중적외선 분광법은 산란이 적고, 포도당이 특정 중적외선 파장을 흡수할 수 있어서 농도를 더 정확하게 측정할 수 있다. 하지만 침투 깊이가 마이크로미터로 매우 작고 장비가 비싸다는 등의 단점이 있으며, 라만 분광법은 온도 변화에 덜 민감하며 높은 특이성을 갖지만, 레이저의 파장과 강도가 불안정하며 긴 수집 시간을 갖는다는 등의 단점이 있다[3]. 광음향 분광법은 빛의 흡수와 열팽창에 따른 음향 신호 생성에 의존하기 때문에 빛보다 조직 산란에 상대적으로 덜 영향을 받아 광학 분광법의 침투 문제를 극복하지만[8], 피부 두께, 거침, 수분 및 기타 피부 상태로 인해 도전을 겪으며, 지방 및 단백질과 같은 혈액의 다른 성분들의 존재가 문제가 될 수 있다[7]. 나노물질 기반의 센싱은 주로 인간의 소변, 침, 땀 및 눈물에서 포도당을 정밀하게 감지하며 높은 감도와 경제성을 갖는 방법이지만 소변의 경우 낮은 정확도를 가지며 침은 낮은 농도 크기를 갖는 등의 문제가 있다[9]. 그에 반해 전자기파를 이용한 방법은 혈당의 유전 특성 변화의 불확실성에 의해 제한되고, 민감도와 선택도의 향상이 필요하지만, 앞의 방법들과는 달리 피부색 등에 영향을 받지 않아 사람별 교정이 요구되지 않으며 재사용이 가능하고 제작이 쉽고 비용이 적게 든다는 등의 장점이 있다[6],[7].
전자기파를 기반으로, IDC(interdigital capacitor)는 간단한 설계, 저렴한 제조 비용 및 다른 전자 부품과 쉽게 결합할 수 있다는 특징으로 생물학, 물리학 등 다양한 과학 분야의 센서 응용에서 광범위하게 연구되었다. 그중에서도 IDC는 유전율 측정, 습도 센싱 어플리케이션, 마이크로파 응용 등에 사용되었다[10]. IDC 센서는 상당히 큰 프린징 필드를 가져 주변 매질의 유전 상수 및 손실 탄젠트의 변화에 영향을 받게 되고, 이는 공진기의 S 파라미터 및 주파수를 변화시킨다. 이를 통해 포도당과 염화나트륨 수용액의 농도에 따른 S파라미터 및 주파수 변화를 감지할 수 있다.
물은 사람의 혈액의 약 50 %의 비중을 차지하고 있으며, 혈액은 포도당뿐만 아니라 비율이 변화하는 나트륨, 칼슘, 마그네슘, 염화물 등의 다른 필수적인 요소들을 포함하고 있다[11].
이에 본 논문에서는 이를 반영하여 2-1절에서 공진 주파수를 선정함에 있어 물의 온도 및 주파수에 따른 유전율의 변화를 고려하였으며, 2-2절에서는 IDC 형태를 기반으로 공진기를 설계하였다. 3-1절에서는 혈액 내 포도당 및 다른 요소들을 고려하여 수용액의 적절한 농도 범위를 선정하였으며, 3-2절에서 시뮬레이션 및 측정을 통해 설계한 공진기에 유체 채널을 위치시키고 수용액의 농도에 따른 반사 계수의 크기 변화 및 주파수, 그리고 위상 변화를 확인하였다. 그 결과 같은 크기의 유체 채널을 이용해 0~400 mg/dL 범위에서 포도당 수용액의 농도에 따른 투과 계수의 변화를 약 0.03 dB를 확인한 CSRR(complementary split ring resonator)과 그 성능을 비교해 보았을 때[6], 본 논문에서 제안하는 IDC 기반의 공진기는 더 작은 크기를 가지며, 포도당 수용액의 농도에 따른 S 파라미터에 대한 민감도가 향상된 것을 확인할 수 있었다.
II. 센서 설계
물의 유전율은 온도와 주파수에 의존하고 그 식은 식 (1)과 같으며, ε∞, ε0, ω 와 Twater, 그리고 τ는 각각 광
학, 정적 유전율, 각주파수와 물의 온도, 그리고 회전 완화 시간을 의미한다[12]. 사람의 체온은 약 36.5°이지만,
실험실 내부 온도인 약 20°를 식 (1)에 대입하였을 때 3 GHz 이상의 주파수에서 주파수 변화에 대한 물의 유전율이 급격하게 변한다는 것을 알 수 있다.
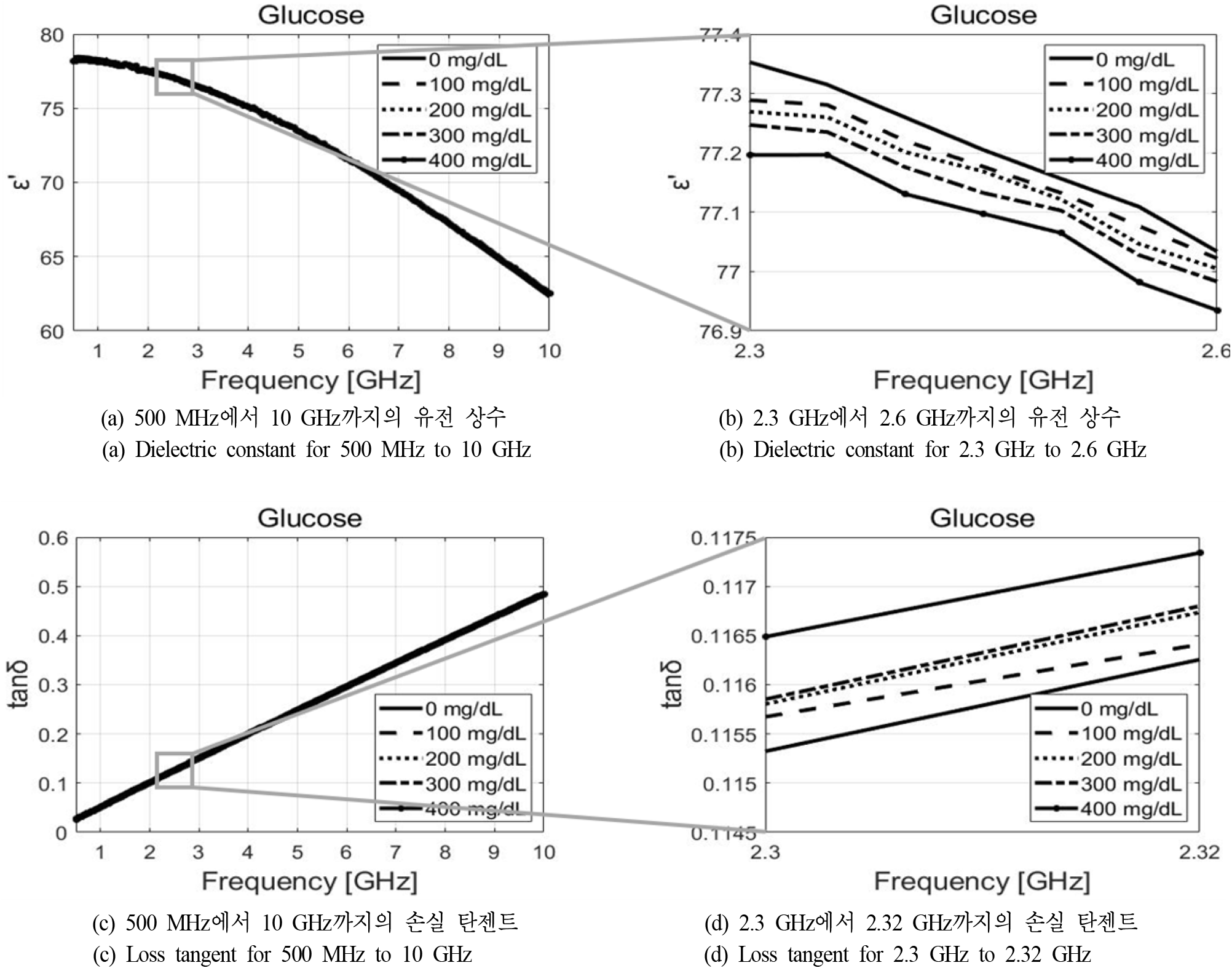
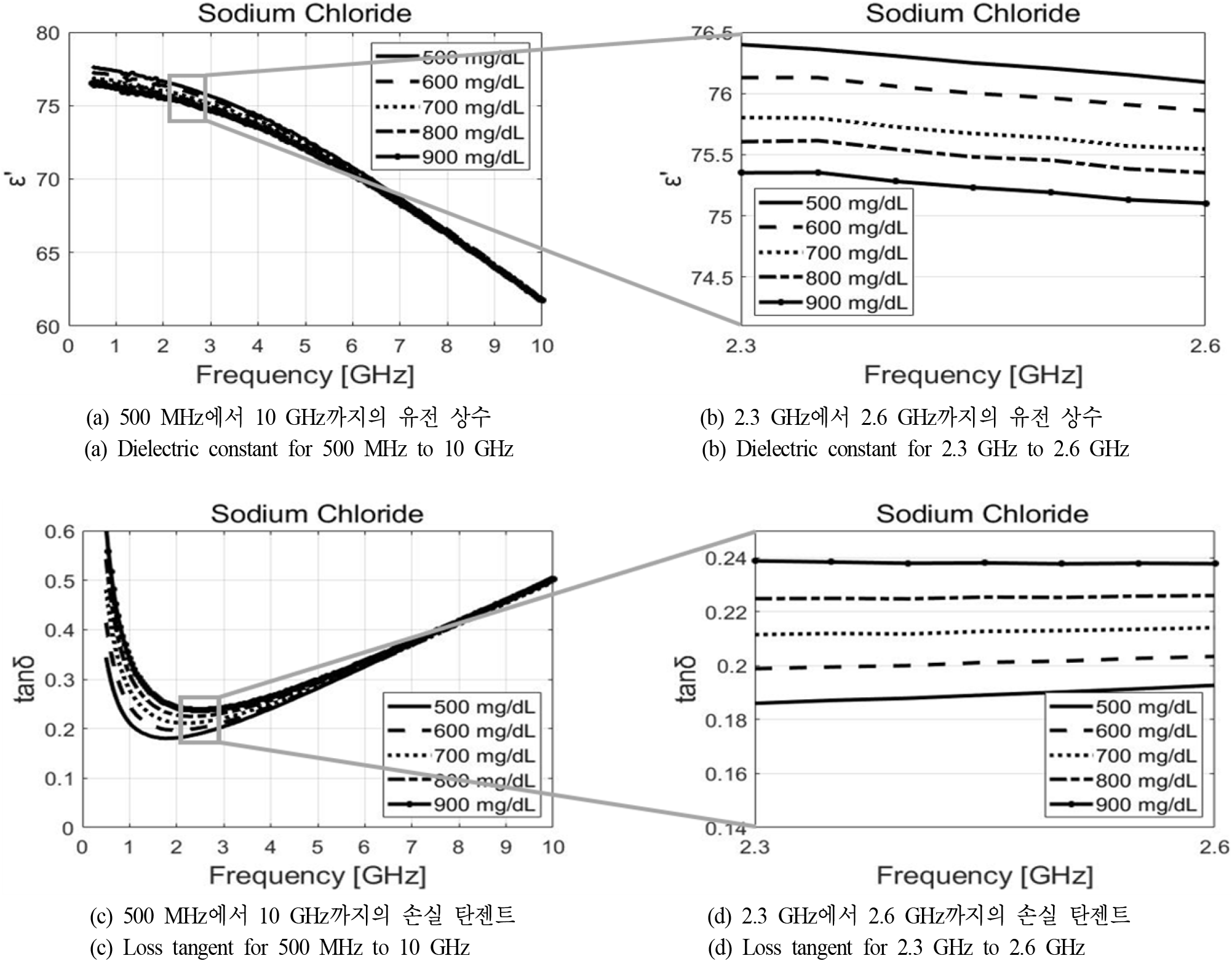
그림 1 및 그림 2는 개방형 동축 유전율 프로브(85070D)와 PNA 서비스 네트워크 분석기(E8364A)를 이용하여 500 MHz부터 10 GHz까지 측정한 특정한 범위 내에서의 포도당과 염화나트륨 수용액의 유전 상수와 손실 탄젠트이다. 그림 1(a)와 그림 1(c), 그리고 그림 2(a)와 그림 2(c)는 주파수에 따른 수용액의 유전 상수 및 손실 탄젠트에 대한 경향성은 파악할 수 있지만, 농도에 따른 변화가 보이지 않기 때문에 이를 명확하게 보기 위해 주파수 대역을 조정하여 각각 그림 1(b)와 그림 1(d) 그리고 그림 2(b)와 그림 2(d)에 나타내었다. 이로부터 주파수가 커질수록 농도에 따른 유전 상수 및 손실 탄젠트의 차이가 점점 작아지는 것을 확인할 수 있다. 이 점을 앞서 언급한 물의 유전율과 함께 고려해 보았을 때, 공진 주파수를 작게 설정하는 것이 포도당과 염화나트륨 수용액의 농도에 따른 S 파라미터 및 공진 주파수의 변화를 비교적 더 크게 감지할 수 있다는 것을 알 수 있다. 하지만, 공진기의 크기를 줄여야 한다는 점을 고려하여 ISM 주파수 대역인 2.45 GHz 대역을 공진 주파수로 선정하였다.
IDC의 커패시턴스 c를 구하기 위한 근사식은 식 (2)와 같으며, d2는 핑거의 길이, N은 핑거의 개수, A1과 A2는 핑거의 단위 길이당 커패시턴스, εr은 기판의 상대 유전 상수를 의미한다. 유한한 기판에 대해서 A1과 A2는 각각 근사식 식 (3) 및 식 (4)를 통해 구할 수 있으며, h와 b는 각각 기판의 두께와 핑거의 폭을 의미한다[13].
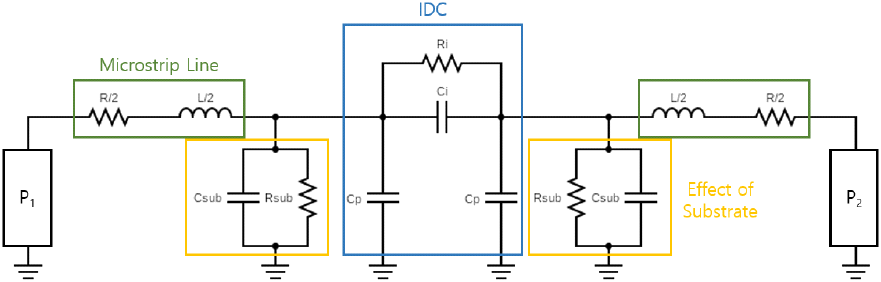
공진 특성을 이용하기 위해 인덕턴스 성분 적용을 위한 마이크로스트립 라인을 추가로 연결하였으며, 설계한 공진기의 공진 주파수를 구하는 식은 식 (5)와 같고 설계한 IDC 공진기에 대한 등가 회로는 그림 3과 같다. 파란색으로 표시된 회로에서 Ri, Ci 그리고 Cp는 IDC의 손실, 커패시턴스, 그리고 IDC에서 접지면으로의 직접적인 플럭스(flux)로 인한 커패시턴스를 나타내고[14], 초록색과 주황색으로 표시된 회로는 각각 인덕턴스 성분을 위한 마이크로스트립 라인, 그리고 두 도체 사이의 유전체 기판 구조로 인한 유전 손실과 커패시턴스를 나타낸다.
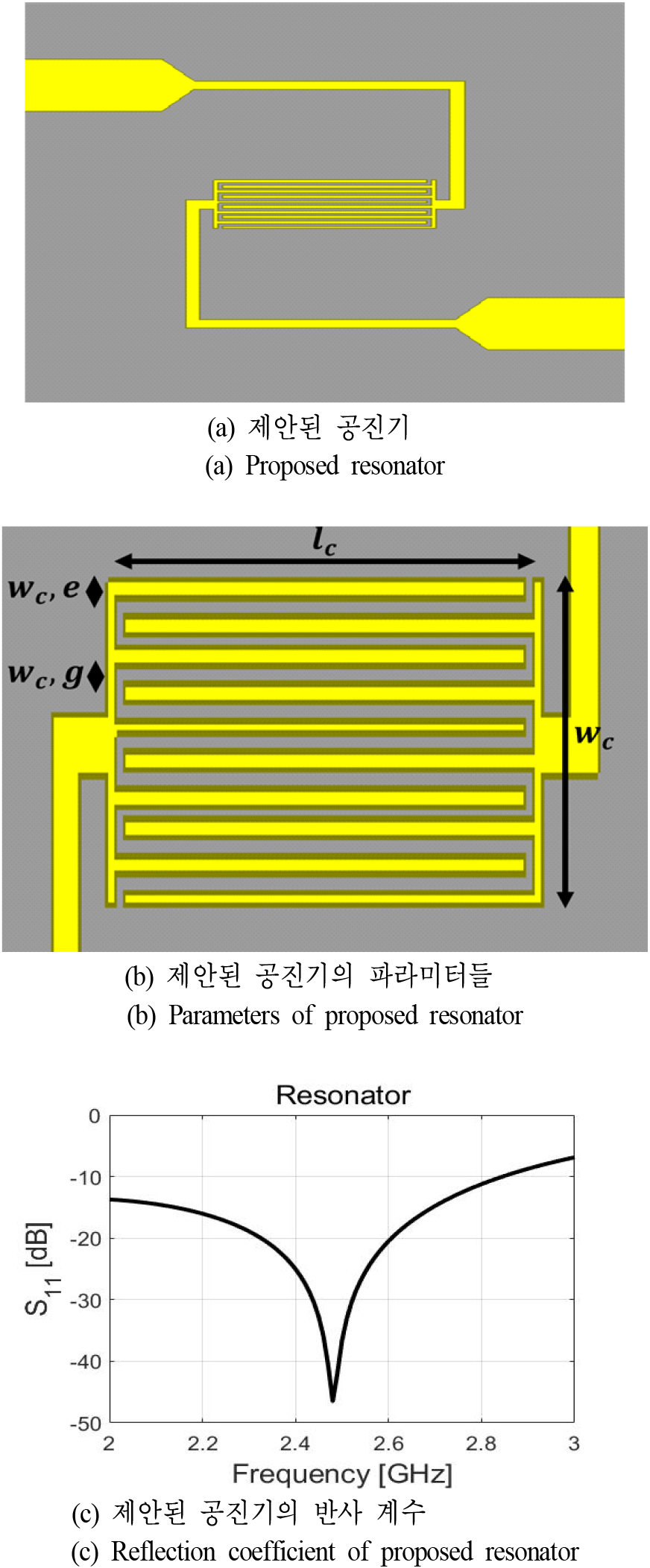
기판은 유전율 2.2, 손실 탄젠트 0.0009인 TACONIC사의 TLY-5를 사용하였으며 설계한 공진기는 그림 4(a)와 같다. 공진기의 파라미터, 그리고 반사 계수를 차례로 그림 4(b)와 그림 4(c)에 나타내었으며, 그림 4(b)에 표시된 파라미터들의 길이 lc, wc, wc,e 그리고 wc,g는 각각 6 mm, 2.28 mm, 0.12 mm 그리고 0.12 mm이다.
그림 4(c)는 HFSS를 이용하여 시뮬레이션 한 공진기의 반사 계수를 나타낸 그래프로, 의도한 대로 2.48 GHz에서 공진하였으며, 공진 주파수에서 약 −46.5 dB의 반사 계수값을 가졌다.
III. 시뮬레이션 및 측정 결과
포도당 수용액의 농도는 저혈당부터 고혈당의 농도 범위를 모두 고려하여 0에서 400 mg/dL까지로 설정하였다[15]. 염화나트륨 수용액의 농도 범위는 혈액 속 포도당을 제외한 다른 요소들의 농도 범위인 표 1을 바탕으로 설정하였다[11]. 표 1을 보면 나트륨과 염화물의 농도와 그 범위가 다른 요소들에 비해 큰 것을 알 수 있다. 그렇기 때문에 나트륨과 염화물의 농도를 포도당의 농도와 구분해야 할 요소로 보았으며, 본 연구는 추후 포도당과 나트륨, 그리고 염화물 혼합물에서 각각의 농도를 감지하기 위한 연구의 기초 연구이기 때문에 혼합물 내 구분되어야 할 물질에 대한 변수를 줄이기 위해 나트륨과 염화물을 염화나트륨으로 고려하였다. 염화나트륨의 농도 범위는 전해질의 농도 단위인 mEq/L를 사용하여 혈액 속에 포함된 나트륨과 염화물의 농도를 반영하였다. 나트륨의 1 mEq/L는 2.99 mg/dL로, 310~333 mg/dL의 범위는 약 135~145 mEq/L에 대응되는 것을 알 수 있다. 비슷하게 염화물의 1 mEq/L는 3.5453 mg/dL로 337~372 mg/dL의 범위는 약 95~105 mEq/L에 대응되게 된다. 염화나트륨의 1 mEq/L는 염화물과 나트륨의 합이므로 5.8443 mg/dL가 되는데, 염화물과 나트륨의 농도 범위를 모두 포함하기 위해서 95~145 mEq/L로 설정하였으며, 이를 포도당의 농도 단위로 변환하면 약 500~900 mg/dL가 된다. 이를 바탕으로 포도당과 염화나트륨 수용액의 농도는 각각 0~400 mg/dL와 500~900 mg/dL로 설정하고 시뮬레이션과 측정을 진행하였다.
| Other components | Concentration range [mg/dL] |
|---|---|
| Na | 310~333 |
| Cl | 337~372 |
| Mg | 1.8~3.4 |
| Ca | 8.5~10.5 |
| K | 13.6~21.4 |
그림 5는 제안된 공진기의 전기장 분포를 나타내는데, IDC에 프린징 필드로 인해 강한 전기장이 분포되어있는 것을 알 수 있다. 수용액의 농도에 따른 유전율 변화를 민감하게 감지시키기 위해 그림 6과 같이 1/32 inch 크기의 내부 지름을 갖는 유체 채널을 IDC의 중심에 가로로 위치시켰으며, 유체 채널 내 수용액 위치에 유전율 프로브를 통해 측정했던 수용액의 유전율 정보를 적용하면서 시뮬레이션을 진행하였다. 포도당 수용액의 경우에 농도 범위를 0~400 mg/dL로 설정하였지만, 크기 변화가 매우 작기 때문에 100 mg/dL 단위로 시뮬레이션할 경우 오차에 의해 이상적인 농도 변화 감지가 어려웠다. 그렇기 때문에 포도당 수용액의 경우에는 0, 400, 1,000 mg/dL에 대해 시뮬레이션하였으며, 포도당과 염화나트륨 수용액의 농도에 따른 시뮬레이션 결과 그래프를 그림 7에 나타내었다. 그림 7(a)는 농도에 따른 주파수 변화를 나타낸 그래프로, 포도당 수용액은 농도가 0 mg/dL에서 400 mg/dL로 변할 때 주파수가 0.5 MHz 감소하고, 1,000 mg/dL로 변할 때에는 0 mg/dL 대비 1 MHz 증가한 것을 볼 수 있다. 그림 1(b)를 보면 포도당 수용액의 농도가 증가함에 따라 유전율이 작아지는 것을 확인할 수 있는데, 이로 인해 농도가 증가하면 공진 주파수도 증가하여야 한다. 하지만, 포도당 수용액은 농도에 따른 유전율 변화가 매우 작은 것을 알 수 있다. 그렇기 때문에 0 mg/dL에서 400 mg/dL로 농도가 변할 때 주파수가 감소하는 것은 매우 작은 유전율 차이로 인한 시뮬레이션 오차일 것으로 보이며, 1,000 mg/dL로 농도가 변함에도 1 MHz의 변화만을 보였다. 염화나트륨의 경우에는 500 mg/dL에서 900 mg/dL로 농도가 증가함에 따라 총 12.5 MHz의 변화율을 보였다. 그림 7(b)는 농도에 따른 반사 계수를 나타낸 그래프로, 포도당과 염화나트륨 수용액 모두 농도가 증가함에 따라 포도당은 400 mg/dL까지 약 2.44 dB, 염화나트륨은 900 mg/dL까지 약 3.24 dB만큼 반사 계수가 증가한 것을 확인할 수 있다. 그림 1(d)와 그림 2(c)를 통해 농도가 증가함에 따라 포도당과 염화나트륨 수용액 모두 손실 탄젠트가 증가하는 것을 확인할 수 있으므로 이를 통해 이론에 맞는 시뮬레이션 결과가 나왔음을 알 수 있다.
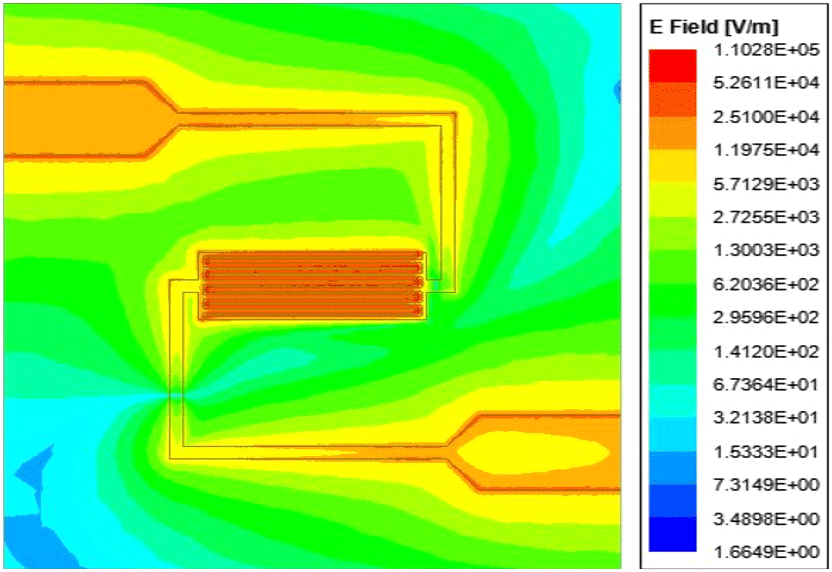
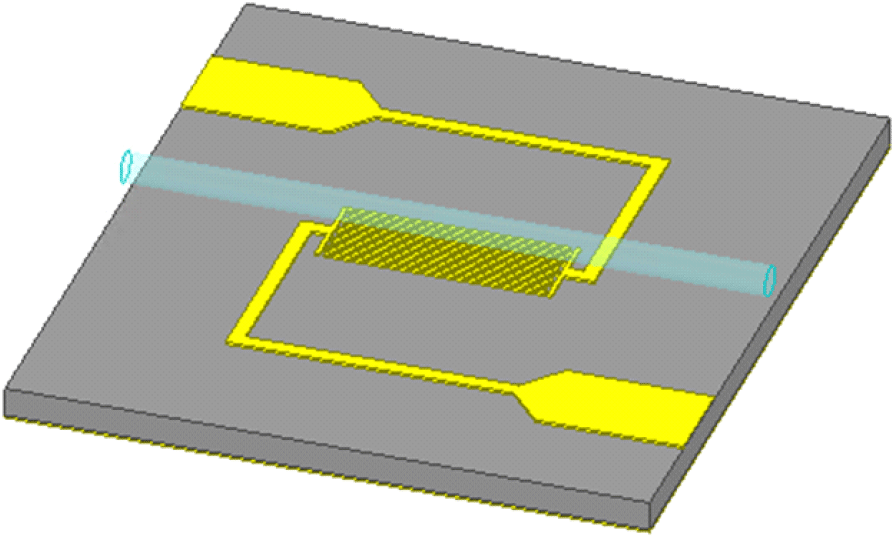
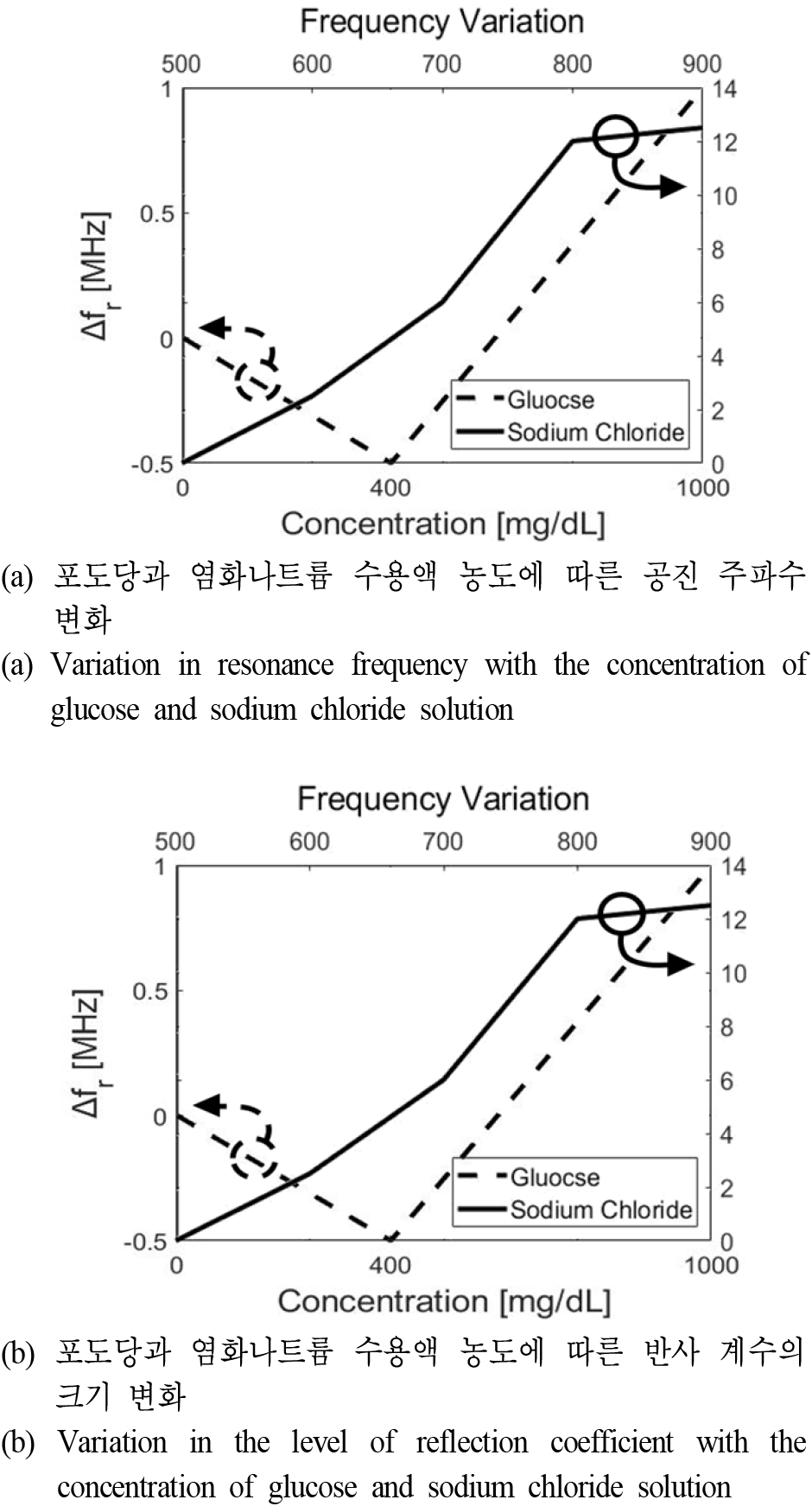
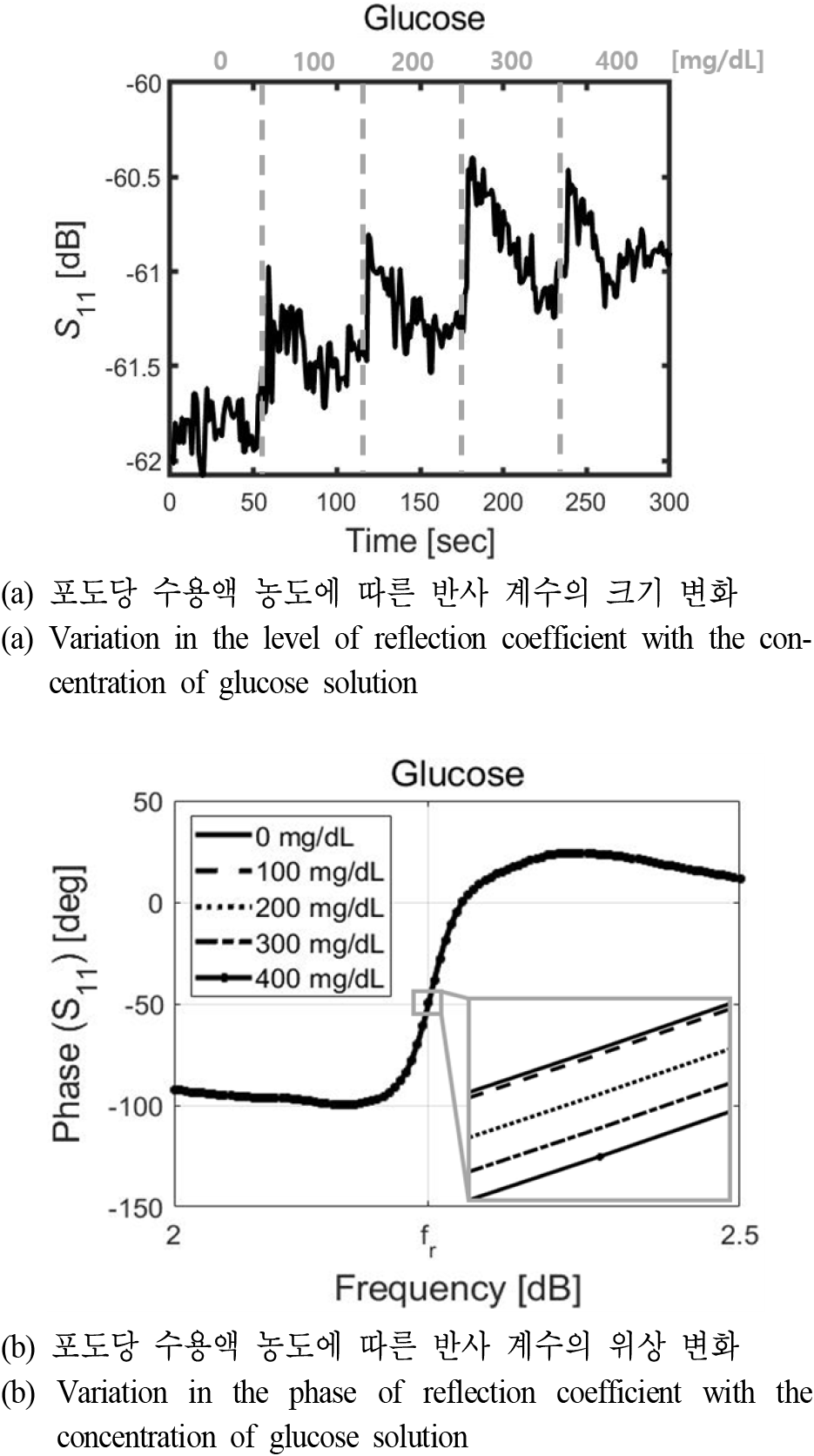
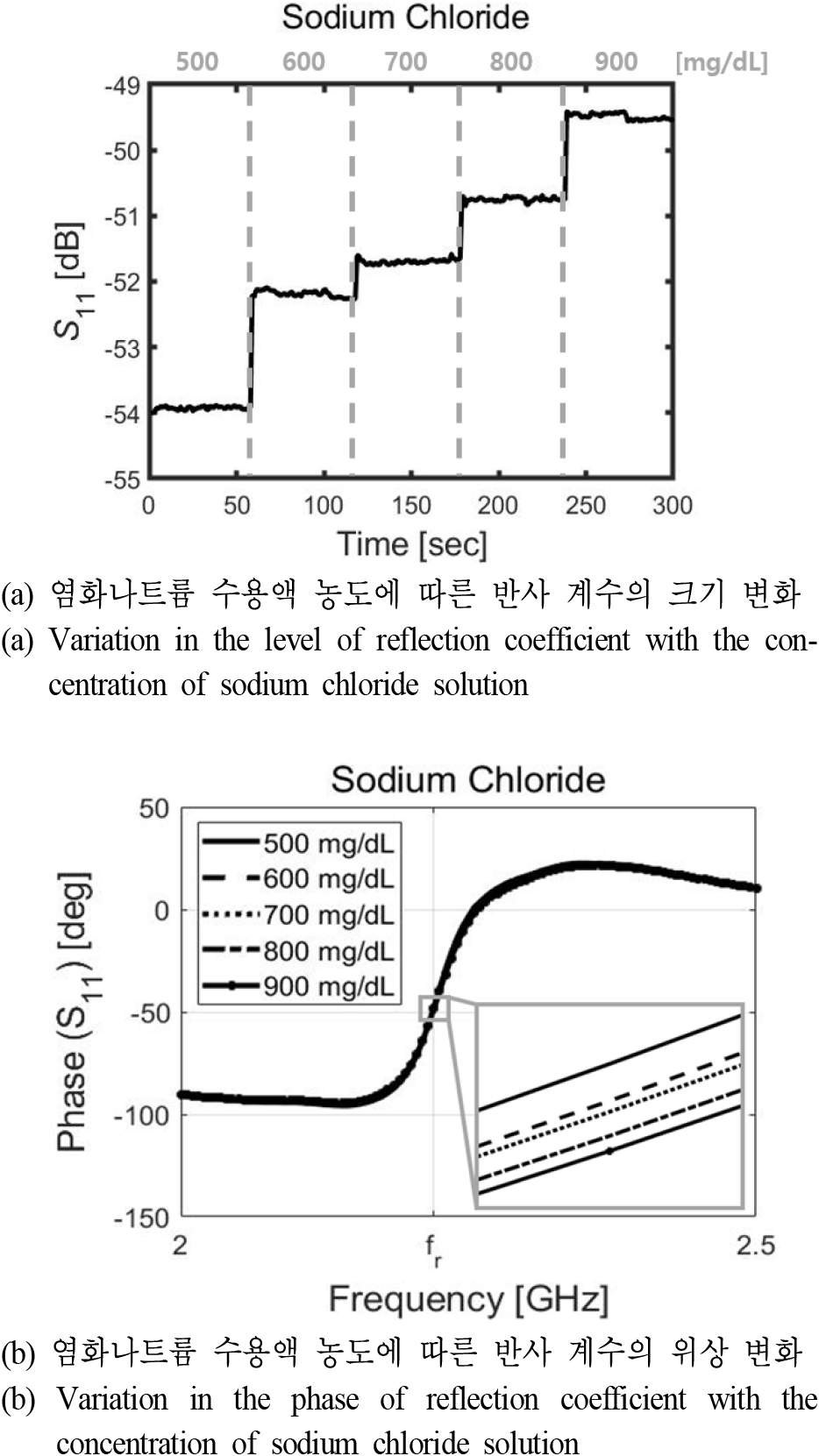
그림 8은 측정 셋업을 나타낸 그림으로, 측정 장비로는 키사이트의 센스 네트워크 어널라이저(E5071B)를 사용하였다. 0초부터 300초까지 60초마다 농도를 변화시켜 가며 연속적으로 측정하기 위해 GPIB 케이블을 이용하였고, 시뮬레이션과 같은 위치에 유체 채널을 올린 후 실린지 펌프(syringe pump)를 이용하여 유체 채널 내 수용액의 농도를 조절해 주었다. 포도당과 염화나트륨 수용액의 농도에 따른 반사 계수 및 위상에 대한 그래프를 그림 9와 그림 10에 나타내었다. 그림 9(a)는 0에서 400 mg/dL까지 포도당 수용액의 농도에 따른 반사 계수의 레벨 변화를 나타낸 그래프로, 염화나트륨 수용액 대비 변화 정도가 매우 작기 때문에 장비의 잡음이 두드러져 보이는 것을 알 수 있으며 응답 시간이 발생하였다. 그렇기 때문에 이를 제외하고 포화되었을 때의 반사 계수값들을 평균을 취하여 구한 변화량은 약 0.9 dB였으며, 농도에 따른 반사 계수의 위상 변화는 그림 9(b)에 나타내었다. 농도에 따른 위상의 변화가 크지 않았기 때문에 공진 주파수에서의 위상을 확대해 보았으며, 농도가 증가함에 따라 위상이 −49.52°에서 −49.79°까지 선형적으로 변하는 것을 확인하였다. 그림 10(a)는 500에서 900 mg/dL까지 염화나트륨 수용액의 농도에 따른 반사 계수의 크기 변화를 나타낸 그래프로, 염화나트륨의 경우에는 포도당 수용액처럼 응답 시간이 발생하였으나 염화나트륨의 농도에 따른 반사 계수 변화량 대비 그 정도가 매우 작았다. 측정을 통해 얻은 지정한 염화나트륨의 농도에 따른 반사 계수 크기의 변화량은 약 4.44 dB였으며, 농도에 따른 반사 계수의 위상 변화는 그림 10(b)에 나타내었고, 염화나트륨의 농도에 따른 위상 변화도 포도당과 마찬가지로 농도가 증가함에 따라 −47.66°에서 −48.65°까지 선형적으로 변하는 것을 확인하였다. 유체 채널 및 증류수(0 mg/dL)로 인해 공진 주파수가 약 2.22 GHz까지 이동하였으며, 시뮬레이션 결과와 달리 포도당과 염화나트륨 수용액 모두 농도에 따른 공진 주파수 및 대역폭의 변화가 나타나지 않았기 때문에, 본 논문에서는 크기 및 위상 변화를 제외하고는 Q-factor 등의 변화를 확인할 수는 없었으나 수용액의 농도에 따른 공진 주파수 및 대역폭의 변화를 감지하기 위한 연구는 활발히 진행 중이다[11,16,17].
IV. 결 론
본 논문에서는 IDC 기반의 공진기를 이용하여 포도당 및 염화나트륨 수용액의 농도에 따른 S파라미터를 감지하였다. 공진기에서 전기장이 가장 분포하는 곳에 유체 채널을 위치시키고 포도당과 염화나트륨 수용액의 농도를 각각 0~400 mg/dL, 500~900 mg/dL로 변화시켜 가면서 시뮬레이션 및 측정을 진행하였다. 그 결과 주파수 및 반사 계수값의 변화가 포도당보다 염화나트륨 수용액의 농도 변화에서 더 크게 나타남을 확인했으며, 이를 통해 포도당 측정 시 혈액 내 다른 요소들, 즉 염화물 및 나트륨 등의 농도를 파악하는 것이 중요하다는 것을 알 수 있었다. 측정을 통해서는 포도당 및 염화나트륨 수용액의 농도에 따른 반사 계수 크기는 각각 약 0.9 dB, 4.44 dB, 그리고 위상은 각각 약 0.27°, 0.99° 변화한 것을 확인하였다. 시뮬레이션 시 염화나트륨 수용액은 공진 주파수가 MHz 단위로 변화함을 확인했지만, 측정을 통해서는 그 변화를 확인할 수 없었는데 이는 유체 채널의 위치로 인한 오차일 것으로 보이며, 추후 공진기의 크기를 더욱 최소화하고 지그를 통해 채널의 위치를 고정하는 등의 방법으로 이를 개선하고자 한다.