특집논문/SPECIAL EDITION
848.5 MHz CDMA(Code Division Multiple Access) 전자파 노출이 흰쥐 해마 HSP70 발현에 미치는 영향 연구
김혜선1
,
안영환1,*
Effect of Exposure to 848.5 MHz Code Division Multiple Access on HSP70 Response in Rat Hippocampus
Hye Sun Kim1
,
Young Hwan Ahn1,*
Author Information & Copyright ▼
1Department of Neurosurgery, Ajou University School of Medicine
© Copyright 2019 The Korean Institute of Electromagnetic Engineering and Science. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Jun 26, 2020; Revised: Jul 07, 2020; Accepted: Jul 08, 2020
Published Online: Oct 31, 2020
요약
흰쥐에 전신 평균 2 W/kg SAR의 CDMA 신호 전자파(848.5 MHz, 77.5 V/m)를 하루 1시간 또는 8시간 동안, 1주일에 5일, 2주간 노출 후 해마에서 HSP70 단백질 발현 변화를 평가하였다. 전자파 노출 실험 시 모든 시험군의 사료 공급 및 급수는 차단되었다. 하루 1시간 전자파에 노출된 흰쥐 해마에서 HSP70 단백질의 발현이 sham 노출군과 비교하여 증가됨이 관찰되었으나. 8시간 노출된 흰쥐의 해마에서는 유의미한 변화가 관찰되지 않았다.
Abstract
In this study, rats were exposed to code division multiple access(CDMA) signals at a whole-body average specific absorption rate of 2 W/kg for 1 or 8 h for five days for two weeks to evaluate the effect of exposure to 848.5 MHz CDMA signals(848.5 MHz, 77.5 V/m) on the protein expression of hippocampal HSP70. The rats in all experimental groups did not have access to food or water during exposure to radiofrequency radiation. It was found that the protein expression of hippocampal HSP70 significantly increased in the 1 h CDMA-exposed rats compared to those in the sham-exposed group. No significant change in 8 h CDMA-exposed rats was observed.
Keywords: RF-EMF; CDMA; Hippocampus; HSP70; Rat
Ⅰ. 서 론
무선 주파수 전자파를 이용한 다양한 통신 장비 사용이 증가함에 따라 전자파 인체 노출에 대한 우려가 커지고 있다. 전자파(EMF, electromagnetic field)는 일종의 스트레스 인자 중 하나로서 스트레스 반응(stress response)을 유도하는 것으로 밝혀져 있다 [1]. 특히, 무선주파수대역 전자파(radiofrequency electromagnetic field)는 열을 발생시키며, 이러한 반응은 외부의 자극에 의해 스트레스 단백질(HSP, heat shock protein)을 매개로 반응하는 것으로 알려져 있다[1]~[4]. 스트레스 단백질은 분자량에 따라 구분되며, HSP 70은 고차구조 형성을 보조하는 단백질인 분자 샤페론(molecular chaperon)의 한 종류이다. HSP 70은 단백질 접힘(folding), 단백질 세포막 이동, 다양한 외부 자극에 대한 세포 보호 등의 역할을 한다[1],[2]. 특히, 알츠하이머병, 파킨슨병, 헌팅턴병, 뇌졸중과 같은 뇌 질환에서 HSP 70의 신경 보호 효과(neuroprotective effect)가 관찰되고 있다[1],[2].
전자파가 HSP70 발현을 증가시켜 스트레스 반응을 유발한다는 사실이 처음 보고[3],[4]된 이후 전자파가 스트레스 단백질에 미치는 영향에 관한 보고가 지속적으로 이루어져 왔다. 본 연구에서는 성체 수컷 흰쥐를 열을 발생시키지 않는 수준인 전신 평균 2 W/kg SAR(specific absorption rate)의 848.5 MHz CDMA 전자파 환경에 2주간에 노출시키고, 전자파에 의한 해마 내 스트레스 단백질 HSP70의 변화 여부를 관찰하였다.
Ⅱ. 재료 및 방법
전자파 노출 실험은 동물용 전자파잔향실(reverberation chamber)에서 848.5 MHz CDMA(code division multiple access) 전자파를 이용하여 수행되었다(그림 1). 본 장치에 대한 설명은 연구진의 이전 논문에 자세하게 언급되어 있다[5]. 잔향실 내부의 나무 테이블에 케이지를 올려두고, 전자파 실험을 수행하였다. 전신 평균 2 W/kg SAR의 전자파 노출을 위해 power output을 7.83 W로 조절하였다.
그림 1. | Fig. 1.
동물용 848.5 MHz CDMA 전자파잔향실. | 848.5 MHz CDMA reverberation chamber for animal study.
Download Original Figure
6 주령 수컷 흰쥐(Sprague-Dawley, 200~250 g, 대한바이오링크)을 구매하여 1주간 안정화시켰다. 실험실 대기 온도는 22±2 °C로 설정하였고, 낮과 밤 사이클은 12시간 간격으로 유지하였으며, 물과 사료는 무제한 공급하였다.
1주일 안정화 후 15마리 흰쥐는 무작위로 1시간 sham 노출군(n=3), 1시간 CDMA 노출군(n=3), 8시간 sham 노출군(n=3), 8시간 CDMA 노출군(n=3)으로 나누었다. CDMA 노출군의 흰쥐를 하루 1시간 또는 8시간 동안 2 W/kg CDMA 전자파에 일주일에 5일간, 2주 동안 노출시켰다. 전자파 노출 중 모든 시험군의 사료와 물 공급을 중단하였다. 본 연구는 아주대학교 동물윤리위원회의 승인(110405-25)을 받아 수행되었다.
양측 해마 조직은 전자파 노출 종료 후 흰쥐로부터 적출하였다. 전체의 해마 조직에서의 HSP70의 발현 변화 여부를 알아보기 위하여 western blot 분석을 실시하였다. RIPA lysis buffer(20 mM Tris-HCl, 150 mM NaCl, 1 mM Na2EDTA, 1 mM EGTA, 1 % NP-40, 1 % sodium deoxycholate, 2.5 mM sodium pyrophosphate, 1 mM beta-glycerophosphate, 1 mM Na3VO4, 1 μg/mL leupeptin. pH 7.5)를 이용해 해마 조직 단백질을 분리하였고, 12 % SDS polyacrylamide gel에서 전기영동한 뒤 PVDF membrane로 옮겼다. HSP70 및 β-actin의 발현 양상을 관찰하기 위해 membrane을 HSP70 항체(sc-32239, Santa Cruz, CA, USA, 1:1000) 및 β-actin항체(sc-81178, Santa Cruz, 1:1,000)를 반응시킨 후 2차 항체인 peroxidase-conjugated anti-mouse antibody(Jackson Immuno Research, USA)를 1:10,000으로 희석하여 반응시킨 뒤 ECL detection solution(Bio-Rad)을 반응시켜 단백질 발현의 변화를 관찰하였다.
SPSS 12.00 for Windows(SSPS, USA)를 사용하여 동계 분석을 실시하였다. 평균 ± 표준 편차로 나타내었고, p< 0.05일 때 통계적으로 유의한 값으로 인정하였다.
Ⅲ. 결과 및 분석
스트레스 단백질은 아주 작은 변화에도 반응을 하는 세포내 위험 요소 평가 인자의 하나로 널리 사용된다[1],[2]. 한 동물 연구에서 틀에 고정된 흰쥐에 6 W/kg SAR의 2.45 GHz 전자파를 20분간 전신 노출 후 뇌 해마의 HSP70 단백질 발현 증가가 관찰되었다[6]. 또, 다른 동물 연구에서는 7.5 W/kg(4 h, 25 W antenna input power, 900 MHz CW (continuous wave signal) SAR의 휴대전화 전자파에 노출된 흰쥐의 소뇌 및 해마에서 HSP70 mRNA 발현 증가가 관찰되었다[7]. 그리고 세포 연구에서 MO54 인간신경교종 세포주에 배양액 온도를 상승시키는 SAR 20 W/kg 이상의 2.45 GHz의 전자파 노출 후 HSP70의 발현 증가가 관찰되었다고 보고하고 있다[8]. 이처럼 여러 연구에서 열 발생 수준의 전자파를 사용하거나 고정된 동물을 대상으로 한 연구에서 스트레스 단백질의 발현 증가가 관찰되었다. 즉, 전자파가 스트레스 단백질 유발의 직접적 원인이 아니라, 열 발생이 원인일 수 있다는 것이다. 따라서 본 연구는 전자파 노출에 의한 흰쥐의 해마조직의 열 발생을 확실하게 배제시키기 위하여 전신 평균 2 W/kg SAR의 CDMA 전자파를 사용하여 동물 실험을 수행되었다(그림 2).
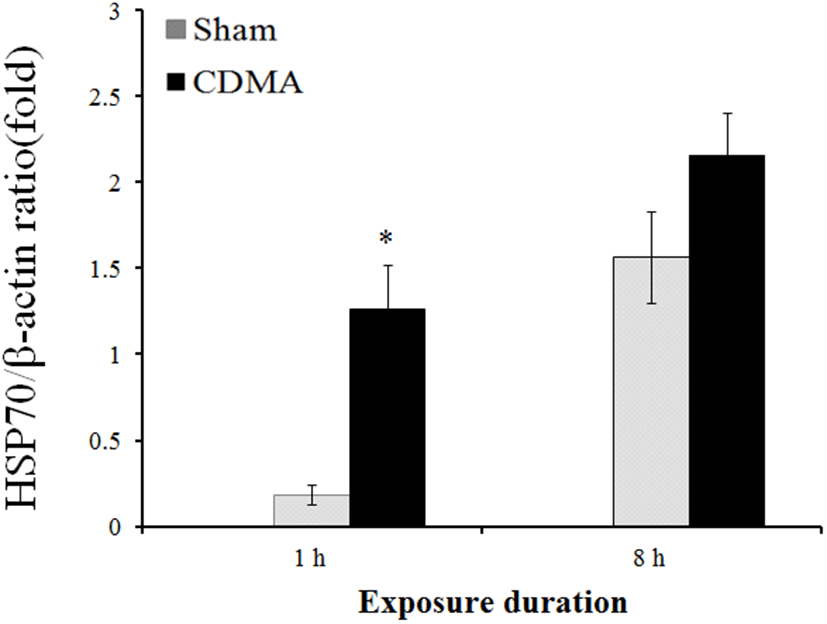
그림 2. | Fig. 2.
전신 평균 2 W/kg SAR의 CDMA 전자파에 하루 1시간 또는 8시간 노출 후 해마 HSP70 발현 양상 | The expression levels of hippocampal HSP70 after exposure to CDMA signal of a whole-body average of 2 W/kg SAR for 1 h or 8 h per day.* p<0.05, sham vs CDMA, Sham: sham 노출군; CDMA: CDMA 전자파 노출군
Download Original Figure
해마는 학습과 기억을 담당하는 신경계의 중요한 영역으로 스트레스가 발생하면 스트레스 단백질이 발현이 증가된다고 알려져 있다[9]. 또한 해마는 시상하부-뇌하수체-부신축(hypothalamic-pituitary-adrenal axis)의 스트레스 반응을 억제하는 것으로 알려져 있다[10]. 해마의 스트레스 단백질 변화는 고체온증[11], 산화스트레스[12] 등의 다양한 자극에 의해서도 증가된다. 본 연구에서 1시간 전자파 노출에 의한 해마내 HSP70 발현 증가는 전자파 노출에 의한 급성 스트레스 반응에 의한 현상으로 정상적인 해마의 기능을 유지를 위한 신경보호 반응으로 추정된다.
한편, HSP70의 과발현이 암 발생의 원인이 될 수도 있다는 보고가 있다[13]. 암 동물 모델에서 HSP70 과발현에 의한 마우스 섬유육종 발생이 관찰되었다[14]. 또한 암 환자에서 HSP70의 과발현이 관찰되는데, 이는 암의 진행 정도와 악성도를 평가하는 마커로 사용될 수 있다[15]. 2016년 미국보건복지부 산하 국립 독성학 프로그램(NTP)은 CDMA 및 GSM(global system for mobile communications) 변조 방식의 휴대전화 전자파에 2년간 노출된 수컷 흰쥐에서 신경계 종양인 악성 심장 초종 및 악성 신경교종이 관찰되었다는 결과를 발표하였다[16]. 하지만 관련 발암 원인에 대한 기전 연구는 수행되지 않았다. 본 연구를 통하여 우리는 전자파의 장기 노출에 의한 만성적인 HSP70 발현이 발암 유발 원인이 될 수도 있다고 가정하였고, 스트레스 단백질과 발암성간의 관계를 평가할 필요가 있다고 생각했다.
전자파 노출 종료 후 해마 조직을 분리하여 western blot 방법으로 단백질 발현을 확인하였다. β-Actin 단백질 발현량을 기준으로 HSP70 발현량으로 보정하였다. CDMA 전자파에 하루 1시간 노출된 흰쥐의 해마 HSP70 단백질의 발현량이 sham 노출군과 비교하여 통계적으로 유의미한 수준으로 증가됨을 확인하였다(p=0.049, Mann- Whitney test)(그림 2). 반면 8시간 노출군의 해마 HSP70 단백질 발현량은 sham 노출군과 비교하여 증가하는 양상은 관찰되었으나, 통계적으로 유의미한 수준은 아니었다(p>0.05, Mann-Whitney test)(그림 2).
본 연구에서, 1 시간 전자파 노출 환경에서와 달리, 8 시간 실험의 경우, 8시간 실험 종료 후 sham 노출군과 CDMA 노출군 모두에서 HSP70 단백질 발현이 비슷한 수준으로 증가하였다. 본 연구에서는 전자파에 의한 물 온도 변화 및 물병에 의한 전자파 노출량 변화에 따른 오차를 줄이고자 전자파 노출 기간 동안 모든 시험군의 급수를 제한했다. 체중 300 g의 흰쥐는 하루 평균 약 15 mL의 물을 섭취한다. 흰쥐는 한 번에 많은 양의 물을 섭취하는 사람과 달리 물을 조금씩 자주 섭취하는 것으로 알려져 있다. 따라서 동물 실험 가이드라인에서는 흰쥐 사육 시 하루 18시간 이상 물을 공급하도록 권장하고 있다. 본 연구진은 하루 8시간의 급수 제한이 하루에 필요한 물 섭취에 지장을 주었을 것으로 추측하였다. 동물 실험 시 급수를 장시간 제한하면 스트레스 반응을 포함하는 동물의 생리학적 변화가 유발된다고 보고하고 있다[17],[18]. 그리고 이번 연구 결과가 8시간 급수 제한에서 기인되었을 가능성도 있다고 추정하였다. 장시간 급수 제한에 의한 스트레스 유발 가능성이 배제된 환경에서의 추가 전자파 노출 실험이 수행되어야 할 것으로 사료된다.
Ⅳ. 결 론
본 연구는 CDMA 휴대전화 전자파를 이용하여 신경계 변화를 평가하는 연구이다. 전자파에 의해 HSP70이 증가됨을 확인하였다. 전자파가 해마의 스트레스 요인으로 작용하였고, 스트레스를 줄이기 위해 HSP70의 발현을 증가시켰을 것으로 추정하였다. 하지만 장기 전자파 노출실험을 통해 전자파에 의한 HSP70의 영향 연구가 추가로 수행되어야 할 것이다.
Acknowledgements
본 연구는 과학기술정보통신부 및 정보통신기획평가원의 정보통신·방송 연구개발사업의 일환으로 수행하였음. [2019-0-00102, 복합 전파환경에서의 국민건강 보호기반 구축.
References
Z. Li, Srivastava, “Heat-shock proteins,”
Current Protocols in Immunology, vol. 58, p. A.1T.1-A.1T.6, Feb. 2004.

,


D. J. Miller, P. E. Fort, “Heat shock proteins regulatory role in neurodevelopment,”
Frontiers in Neuroscience, vol. 12, p. 821, Aug. 2018.

,

,


M. Shevtsov, “Neurotherapeutic activity of the recombinant heat shock protein Hsp70 in a model of focal cerebral ischemia in rats,”
Drug Design, Development and Therapy, vol. 2014, no. 8, pp. 639-650, May 2014.

,

,


W. B. Pratt, J. E. Gestwicki, Y. Osawa, and A. P. Lieberman, “Targeting Hsp90/Hsp70-based protein quality control for treatment of adult onset neurodegenerative diseases,”
Annual Review of Pharmacology and Toxicology, vol. 55, pp. 353-371, Sep. 2015.

,

,


H. S. Kim, Y. J. Kim, Y. H. Lee, Y. S. Lee, H. D. Choi, and J. K. Pack, et al., “Effect of whole-body exposure to the 848.5 MHz code division multiple access(CDMA) electromagnetic field on adult neurogenesis in the young, healthy rat brain,”
International Journal of Radiation Biology, vol. 91, no. 4, pp. 354-359, Apr. 2015.

,


X. S. Yang, G. L. He, Y. T. Hao, Y. Xiao, C. H. Chen, and G. B. Zhang, et al., “Exposure to 2.45 GHz electromagnetic fields elicits an HSP-related stress response in rat hippocampus,”
Brain Research Bulletin, vol. 88, no. 4, pp. 371-378, Jul. 2012.

,


K. Fritze, C. Wiessner, N. Kuster, C. Sommer, P. Gass, and D. M. Hermann, et al., “Effect of global system for mobile communication microwave exposure on the genomic response of the rat brain,”
Neuroscience, vol. 81, no. 3, pp. 627-639, Sep. 1997.


F. Tian, T. Nakahara, K. Wake, M. Taki, and J. Miyakoshi, “Exposure to 2.45 GHz electromagnetic fields induces HSP70 at a high SAR of more than 20 W/kg but not at 5 W/kg in human glioma MO54 cells,”
International Journal of Radiation Biology, vol. 78, no. 5, pp. 433-440, May 2002.

,


F. L. Woon, S. Sood, and D. W. Hedges, “Hippocampal volume deficits associated with exposure to psychological trauma and posttraumatic stress disorder in adults: A meta-analysis,”
Progress in Neuro-Psychopharmacology & Biological Psychiatry, vol. 34, no. 7, pp. 1181-1188, Oct. 2010.

,


B. S. McEwen, “Protective and damaging effects of stress mediators,”
New England Journal of Medicine, Dialogues Clin Neurosci, vol. 8, no. 4, 367-381, Dec. 2006.

,

,


P. Maroni, P. Bendinelli, L. Tiberio, F. Rovetta, R. Piccoletti, and L. Schiaffonati, “
In vivo heat-shock response in the brain: Signalling pathway and transcription factor activation,”
Molecular Brain Research, vol. 119, no. 1, pp. 90-99, Nov. 2003.

,


I. P. Khomenko, L. Y. Bakhtina, O. M. Zelenina, S. V. Kruglov, E. B. Manukhina, and L. A. Bayda, et al., “Role of heat shock proteins HSP70 and HSP32 in the protective effect of adaptation of cultured HT22 hippocampal cells to oxidative stress”
Bulletin of Experimental Biology and Medicine, vol. 144, no. 2, pp. 174-177, Aug. 2007.

,


M. E. Murphy, “The HSP70 family and cancer,”
Carcinogenesis, vol. 34, no. 6, pp. 1181-1188. Jun. 2013.

,

,


M. JϤϤttelϤ, “Over-expression of hsp70 confers tumorigenicity to mouse fibrosarcoma cells,”
International Journal of Cancer, vol. 60, no. 5, pp. 689-693, Mar. 1995.

,


D. R. Ciocca, S. K. Calderwood, “Heat shock proteins in cancer: Diagnostic, prognostic, predictive, and treatment implications,”
Cell Stress & Chaperones, vol. 10, no. 2, pp. 86-103, Jun. 2005.

,

,


Toxicology and Carcinogenesis Study in Hsd:Sprague Dawrey SD Rats Exposed to Whole-Body Radio Frequency Radiation at a Frequency(900 MHz) and Modulations(GSM and CDMA) Used by Cell Phones,
NTP TR 595, Nov. 2018.

P. M. Goltstein, S. Reinert, A. Glas, T. Bonhoeffer, and M. Hübener, “Food and water restriction lead to differential learning behaviors in a head-fixed two-choice visual discrimination task for mice,”
PLOS ONE, vol. 13, no. 9, p. e0204066, Sep. 2018.

,

,


T. S. Rieg, L. E. Doerries, J. G. O'Shea, and P. F. Aravich, “Water deprivation produces an exercise-induced weight loss phenomenon in the rat,”
Physiology & Behavior, vol. 53, no. 3, pp. 607-610. Mar. 1993.