I. 서 론
자기공명영상(MRI, magnetic resonance imaging) 장치의 자기장 세기 증가는 영상의 신호대잡음비(SNR, signal-to-noise ratio)를 높인다. 향상된 SNR을 이용하여 MRI 영상획득의 고속화 또는 영상의 공간해상도를 높이는 데 활용할 수 있다. 높은 공간해상도를 이용하여 인체 내 미세기관 대상 쉽지 않았던 진단이 가능하게 되었으며, 질환의 조기진단 등 다양한 혜택이 동반된다.
한편, MRI 시스템의 자기장 세기(B0)와 비례하여 조성되는 라모주파수(Larmor frequency. f0, 식 (1))[1]의 공명주파수를 이용하여 MRI 영상신호를 생성하는데, 이때 송신 고주파(RF, radiofrequency) 코일을 이용하여 f0에 변조한 RF 파워를 인체에 인가한다. 식 (1)에서 r는 수소의 자기회전율(42.57 MHz/T)을, B0는 자기장의 세기(T)를 나타낸다.
3T MRI의 경우, 식 (1)에 의하여 약 128 MHz의 주파수가 사용된다. 이 경우, 인체를 구성하는 생체조직의 평균 전자기 물성 즉, 전기 전도도 및 상대 유전율과 주파수를 고려했을 때, 단일 파장의 길이는 약 250 mm이다. 동일한 방식으로 7T MRI는 약 298 MHz이며 약 107 mm의 단일 파장 길이를 갖는다(그림 1).
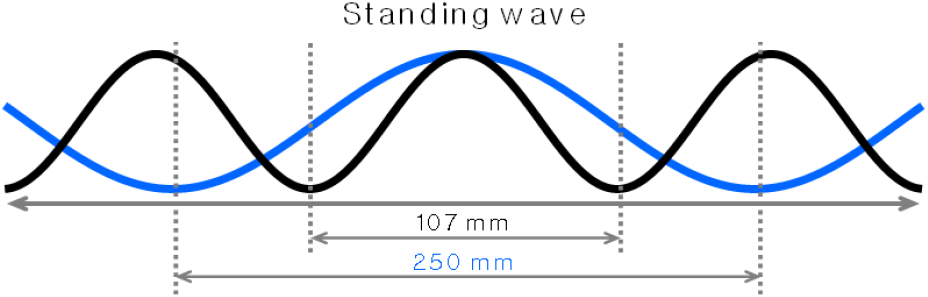
그림 1이 의미하는 바는, 3T MRI 영상의 경우 촬영 영역이 250 mm 이상이 되면 균질한 물체를 촬영했음에도 불구하고 영상에서 최고 및 최저의 밝기가 모두 나타날 확률이 있음을 나타낸다. 즉, 7T MRI에서는 그것보다 작은 영역에서도 이와 같은 현상이 발생할 수 있음을 의미한다. 한편, 전자파 노출의 관점에서 고려할 때, 전자파가 파장의 길이에 따라 인체 내 특정 위치에 집중될 확률 역시 높아짐을 의미한다. 이러한 상황은 자기장(B0)의 세기가 증가함에 따라 인체 전자파 흡수율(SAR, specific absorption rate)이 B0 세기 증가분의 제곱에 비례하여 증가하는 것과는 별도로, 그렇게 증가한 SAR이 특정 영역에 집중하여 소위 국부 SAR 또는 국부에서 급격한 온도 상승이 발생할 수 있음을 의미하며 이는 한 곳에 집중하여 체온이 올라갈 수 있음을 나타낸다[2].
이러한 고자기장 MRI에서의 전자파 안전성 특성에 따라 더욱 각별한 전자파 안전관리가 요구되며, SAR의 정확한 측정 및 예측이 필요하며 관련 규정의 개정과 연구보고가 진행되고 있다[3]~[5].
SAR의 정확한 측정을 위해서는 SAR의 시각화 또한 매우 중요하다. 그러나 SAR의 영상화 기법은 아직 개발되어 있지 않아 MRI 전자파 노출 관리는 주로 RF 파워가 인체에 고르게 분포한다고 가정하는 전체 영역의 SAR의 관점에서 규제하고 있고, 국부 SAR의 경우에는 수치해석에 기반한 기준을 이용하여 예측 및 규제를 하고 있으므로 고자기장 MRI 시스템에서의 국부 SAR 관리는 보수적 수준으로 관리되는 실정이다. 이러한 상황 때문에 3T MRI가 임상적으로 사용될 때, 본의 아니게 비효율적으로 MRI 시스템이 운용되고 있는 것은 사실이다.
본 연구에서는, 이러한 SAR의 시각화를 위하여 MRI를 이용하여 획득한 온도 영상을 기반으로 SAR 영상으로 빠르게 변환하는 방법을 소개한다. 한편, MRI RF 코일을 개발하는 과정에서 RF 코일의 성능 검증 즉, 적절한 SAR 수준을 준수하는지 시각적으로 확인하는 등 개발 입장에서도 활용될 수 있다. 이러한 SAR 변환 방법을 3T MRI 온도영상과 전자기장 수치해석의 비교를 통한 연구 결과를 보이고자 한다.
II. 온도영상 기반 SAR 영상복원
Carluccio 등은 생체조직의 열전도(thermal conduction)율에 저주파 공간 필터링(LPF, low-pass filtering)을 적용하여 온도 영상을 빠르게 계산하는 결과를 발표하였다[6]. 이는 식 (2)에 나타낸 PBE(Pennes’ bio-heat equation)을 근사화하는 방법을 사용한다[7].
이때 는 재료의 밀도, T는 온도, k는 열 전도도, w는 관류 속도, c는 열 용량, Q는 신진 대사율을 나타낸다. bl은 혈류를 의미하며 Tcore는 심부 온도를 나타낸다. Carluccio 등의 선행연구는 식 (2)를 시간 t 간격으로(tint) 이산화하여 온도 영상을 계산하는 것인데, 이때 온도 영상을 실험적으로 획득할 수 있다면 반대로 식 (3)과 같이 SAR 영상을 복원할 수 있다.
식 (3)은 실험적으로 획득한 온도 영상 T에 푸리에 변환을 적용하고, 푸리에 변환 과정에서 고주파 성분이 강조되는 경향을 완화하기 위하여 LPF를 적용하나 좀 더 외곽을 부드럽게 필터링하는 GLPF(gentle LPF)를 적용하였다[10]. 따라서 SAR 영상을 복원하기 위해서, 실험적으로 획득한 온도 변화 영상, 생체조직의 열 용량, 온도 영상의 해상도 정보가 필요하다.
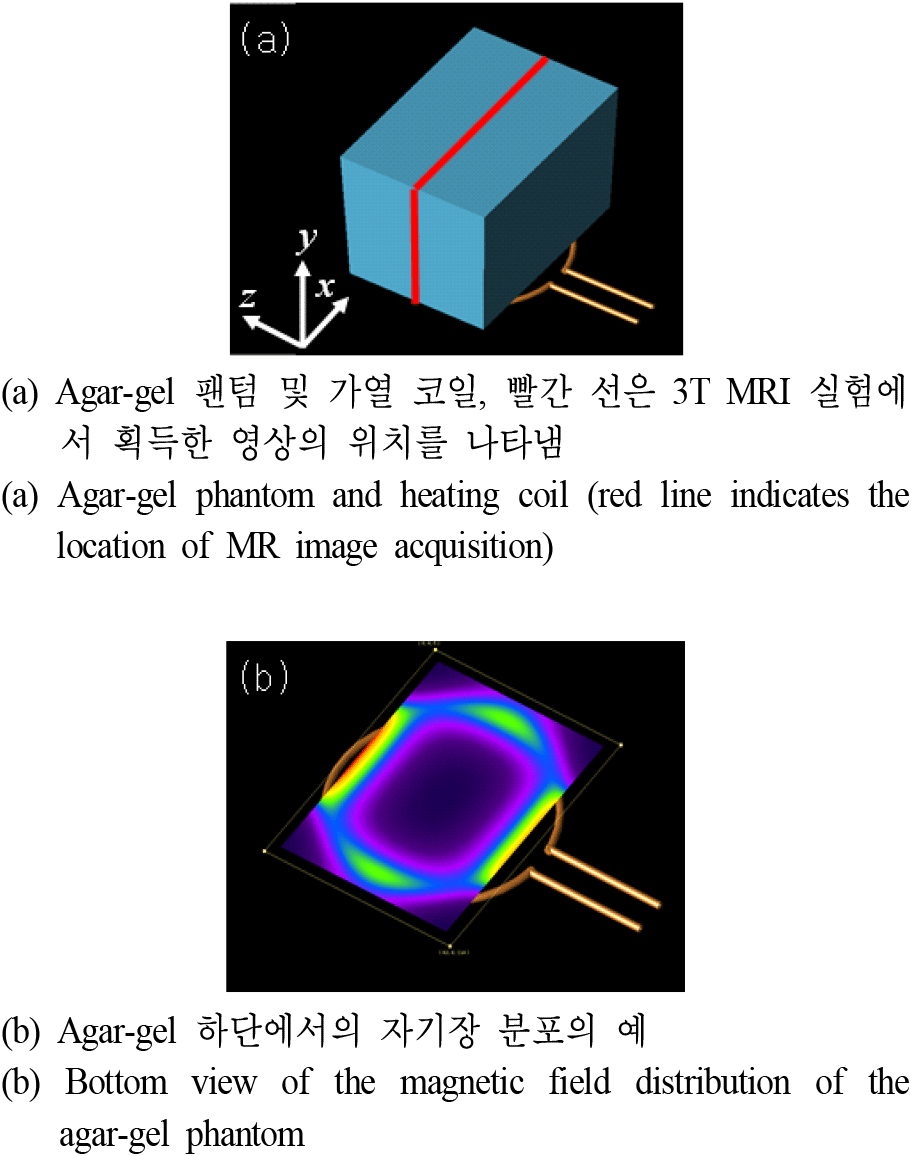
실험에 사용된 팬텀은 그림 2(a)와 같이 사각형 용기(가로×세로×높이=78×68×142 mm3)에 agar (7 g/L), NaCl (10 g/L), 그리고 CuSO4(1 g/L)을 사용하여 제작하였다. 3 T MRI의 공명주파수인 128 MHz에서의 그 팬텀에 대한 전기 전도도 및 상대 유전율은 각각 1.15 S/m, 78이었다. 또한, 팬텀의 밀도는 1,021 kg/m3, 열 용량은 4,200 J/kg°C였다. 한편, 팬텀의 온도변화를 위하여 그림 2(b)와 같이 별도로 제작한 가열 용도의 RF 코일을 사용하였다. 가열 코일은 지름 3 mm(안쪽 지름 1 mm)의 구리관으로 제작하였고 지름을 90 mm로 하여 사각형 팬텀의 밑바닥 영역을 충분히 가열할 수 있도록 하였다. 가열 코일은 64 MHz로 튜닝, 매칭을 하여 3T MRI의 공명주파수에 영향을 미치지 않도록 하였다(그림 3). 이 가열 코일은 별도의 RF AMP(Herley 3445, Lancaster PA, USA)를 이용하여 구동하였다.

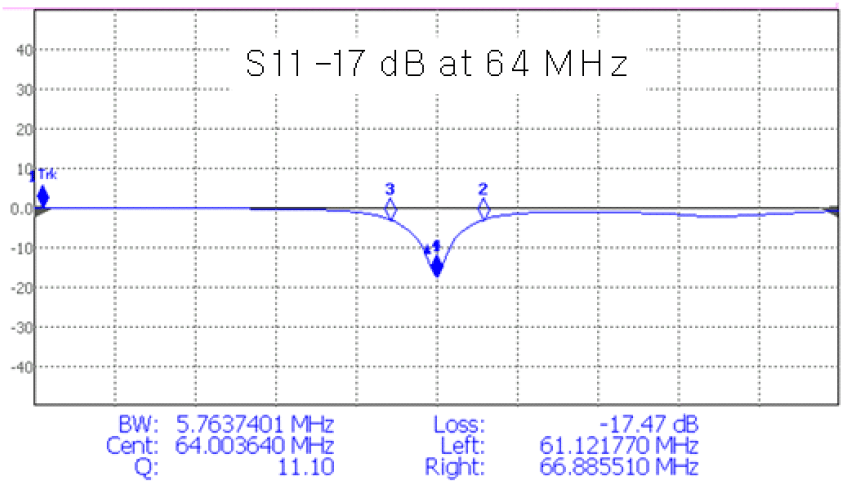
가열 코일과 제작된 팬텀은 2 mm의 간격이 있었고, 가열 코일 위에 해당 팬텀을 올려놓고 측정한 Q(loaded Q) 값은 11.1이었다.
MRI를 이용한 온도 영상법은 양성자 공명 주파수 천이법(PRFS, proton resonance frequency shift) 기법을 사용하였다[8]. PRFS 기법은 온도변화에 대하여 MRI 영상의 위상정보가 민감도 높게 변화하는 현상을 이용한 방법으로써 MR 기반 온도 영상법 분야에서 가장 널리 사용되는 온도 영상획득 방법이며 위상정보를 높은 민감도로 획득하기 위해 경사에코(GRE, gradient echo) 기법을 사용한다. MRI 시스템은 시간에 따라 자기장의 세기가 민감한 수준으로 변동하며 이를 자기장의 위상 변동이라고 하여 온도 변화에 의한 위상을 구분할 수 있어야 성공적인 온도 영상을 획득할 수 있다. 이를 위하여 온도변화에 민감도가 없는 기름 성분의 기준(reference) 팬텀을 촬영 물체 주변에 추가 배치하고 영상 후처리를 통하여 원하는 온도변화에 대한 영상을 추출할 수 있다. 이러한 실험 구성은 그림 4와 같은 선행연구와 같은 구조로 진행하였다[9].

실험에는 3T MRI 시스템(Phillps Achieva, Best, NL)을 이용하였다. 그 제작된 팬텀은 축방향(axial plane, 그림 5(a)) 으로 가열 전/후에 GRE 영상을 획득하였으며, 촬영변수는 TR/TE: 100/10 msec, field of view: 160×160 mm2, matrix size: 224×224, slice thickness: 5 mm(voxel 크기 0.74×0.74 ×5 mm3), flip angle 15°이었다. 가열 전의 GRE 영상획득에는 SNR 향상을 위하여 8회 신호 평균을 적용하여 173초의 촬영 시간이 소요되었으나(ϕ1), 가열 후에는 제작된 팬텀의 온도가 떨어지기 전에 GRE 영상을 획득하기 위하여 신호 평균을 적용하지 않고 22초 동안 빠르게 촬영을 진행하였다(ϕ2). 이와 같은 두 번의 GRE 영상획득 사이에 6분 동안 가열 코일을 이용하여 해당 팬텀을 가열하였고, RF 파워 측정기(ZVH4, FSH-Z14, Rohde & Schwarz Munich, Germany)로 측정한 전달된(forwarded) RF 파워와 반사된(reflected) 파워는 각각 41 W, 1.5 W였다. 이렇게 획득한 두 장의 GRE 영상의 위상정보와 촬영변수를 이용하여 식 (4)와 같이 온도변화에 대한 영상을 복원하였다.
Δϕ(r)은 가열 전/후 GRE 영상의 위상 차이를 나타내고, Δϕdrift(r)는 기름 기준 팬텀으로 측정한 MRI 시스템에서 촬영 시간 동안의 위상 변동의 변화, α는 수소의 화학적 천이 상수(−0.01 ppm/°C), γ는 수소의 자기회전비 (43.57 MHz/T), B0는 자기장의 세기(T), TE는 echo time (초)를 나타낸다.
한편, 실험적으로 획득한 온도 영상으로부터 SAR 영상을 복원할 때 정성적/정량적 정확도를 비교하기 위하여 동일한 구성으로 전자기장 수치해석을 수행하였다. 그림 2와 동일한 구조 및 전자기 물성의 그 팬텀과 가열 코일을 그림 5(a)와 같이 구성하였다.
3D 전자기장 수치해석에는 xFDTD(Remcom, PA, USA)를 사용하였다. Voxel 크기는 1×1×1 mm3으로 구성하였고, 실험과 동일하게 64 MHz로 가열 코일을 구동하였다. 이때 가열 코일은 이상적인 정전류원을 이용하였다. 마찬가지로 제작된 그 팬텀과 가열 코일 간 간격은 2 mm로 설정하였다. 수치해석 결과로 기록된 팬텀, 가열 코일에서 소모된 RF 파워, 공기 중으로 방사된 RF 파워 등을 이용하여 실험 결과와 정합시켰다.
III. SAR 영상복원 결과
3T MRI 실험으로 획득한 온도 영상, 이 온도 영상으로 복원한 SAR 영상을 그림 6에 나타내었다. 아울러, 전자기장 수치해석으로 계산한 SAR, 그리고 비교를 위하여 이 SAR을 이용하여 계산한 온도 영상도 함께 나타내었다[11].
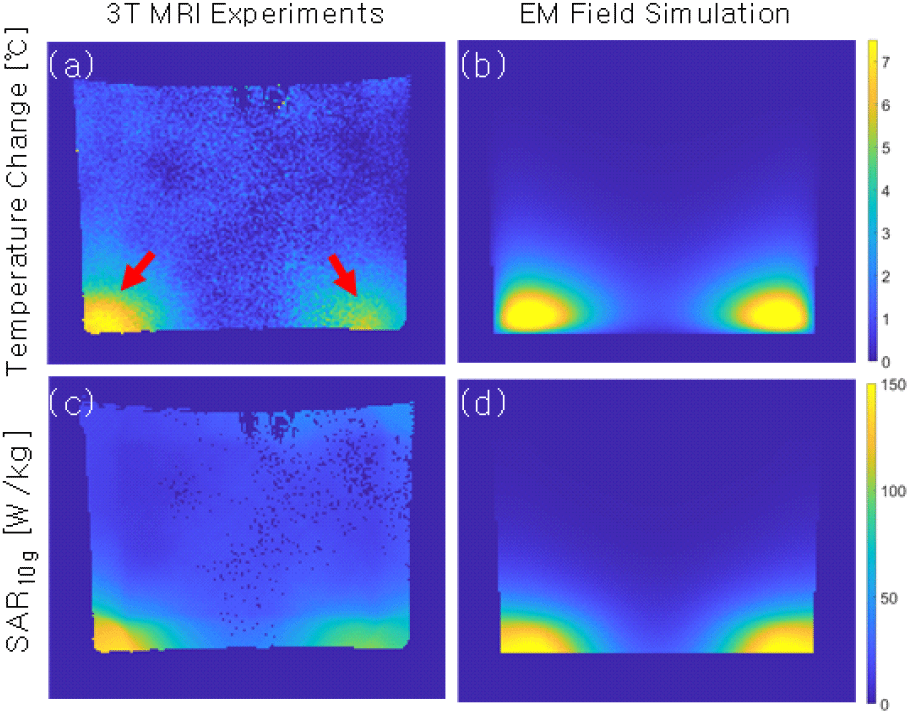
그림 6은 그림 5(a)의 빨간 선이 나타내는 위치에서의 axial 단면 영상이다. 실험적으로 획득한 온도 영상으로부터 SAR 영상을 복원하는 데 5.2초가 소요되었다. 이 결과는 GPU 또는 CPU 가속 기능을 사용하지 않고 3.1 GHz의 CPU 및 16 GB의 시스템 메모리를 가지고 있는 연산용 컴퓨터를 사용한 결과이다. 10-g 평균 SAR의 최댓값은 실험 및 수치해석의 경우 각각 150.1 W/kg, 155.7 W/kg이었으며 약 3.6 %의 오차를 나타낸 결과이다.
한편, 그림 6(a)의 빨간색 화살표가 가리키는 것처럼 실험에서 획득한 온도 영상에서는 온도의 좌/우 차이가 있지만, 수치해석의 결과는 좌/우가 대칭이다. 이는 실험에서는 어떠한 이유로 가열 코일에서의 전류분포가 대칭적이지 않아서 팬텀에 유기된 전류의 분포 역시 비대칭적이었을 것이고, 이에 따라 온도의 변화가 비대칭적으로 발현되었을 것이라고 분석할 수 있다. 반면, 수치해석에서는 이상적인 정전류원을 사용하여 이러한 비대칭 전류분포가 발현되지 않은 것이다. 실험과 같은 조건 즉, 가열 코일의 튜닝/매칭 조건을 수치해석에서 적용한다면 이러한 비대칭 분포가 재현되었을 것이며 향후 연구에서는 이러한 부분을 고려할 계획이다.
IV. 토의 및 결론
본 연구를 통하여 비교적 간단한 구조이기는 하지만 실험을 위해 제작된 팬텀에 대한 SAR 영상을 최댓값 기준 3.6 %의 오차로 복원하였다. 이것으로 온도 영상을 통하여 SAR 영상의 시각화를 가능하게 할 수 있음을 확인하였으며, 이는 MRI 전자파 안전성 관리에 중요한 기여를 할 수 있다.
이 결과는 실험실에서 어렵지 않게 사용할 수 있는 수준의 컴퓨터를 이용한 결과이며 5.2초라는 빠른 속도를 보였다. 물론 I장의 2차원 SAR 결과인 경우이며 슬라이스 개수가 증가하거나 3차원의 경우 SAR 영상복원의 속도가 느려질 수 있으며 이것에 대한 성능은 현재 확인하고 있다.
본 연구에 사용된 SAR 영상복원 알고리즘은 별도의 정규화 과정이 없어 향후 비교적 간단하게 웹 기반으로 기능을 공유할 수 있다. MRI RF 코일 엔지니어들은 RF 코일을 개발하는 과정에서 RF 코일의 성능을 높이는 것이 목표이며 개발 과정에서 SAR 수준 및 분포를 시각적으로 확인함으로써 RF 코일의 성능과 안전성을 검증할 수 있다.
아울러, 이 SAR 영상복원 알고리즘은 근본적으로 RF 코일의 구조/형태와 상관없이 SAR 영상을 복원할 수 있고 온도 영상획득 방법에도 상관없으므로 유용하게 활용될 수 있을 것으로 생각한다. 웹 기반 기능 공유와 별도로, GPU 또는 CPU 등을 활용하는 병렬컴퓨팅 성능을 추가하여 2차원은 물론 복잡한 3차원 구조에서의 SAR 영상복원을 빠르게 수행할 수 있도록 할 계획이다.
향후 연구에서는 다양한 팬텀 구성과 인체 실험을 통하여 본 연구 결과의 유효성을 더욱 검증할 계획이다.