특집논문/SPECIAL EDITION
Complementary Split Ring Resonator(CSRR)를 이용한 포도당과 염화나트륨 수용액의 비침습적 구별
장초롬1, 박진관1, 윤기호*, 육종관1,†
Noninvasive Method to Distinguish between Glucose and Sodium Chloride Solution Using Complementary Split-Ring Resonator
Chorom Jang1, Jin-Kwan Park1, Gi-Ho Yun*, Jong-Gwan Yook1,†
1Department of Electrical and Electronic Engineering, Yonsei University
*Department of Information and Communication Engineering, Sungkyul University
© Copyright 2019 The Korean Institute of Electromagnetic Engineering and Science. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Feb 20, 2018; Revised: Mar 28, 2018; Accepted: Apr 11, 2018
Published Online: Apr 30, 2018
요약
본 논문에서는 complementary split ring resonator(CSRR)을 이용하여 마이크로파 대역에서 비침습적으로 포도당 수용액과 염화나트륨 수용액을 구별하였다. 개방형 동축 프로브로 측정한 두 수용액의 전기적 특성을 기반으로 구별이 유리한 주파수에서 동작하는 CSRR을 설계, 제작하였다. 그리고 공진기의 전기장이 강하게 형성되는 부분에 수용액을 집중시키기 위해 PDMS mold를 제작하였고, 라미네이트 필름으로 수용액과 공진기의 접촉을 방지하였다. 두 수용액의 농도는 인체 혈당 농도 범위인 400 mg/dL까지 100 mg/dL 단위로 나누었고, 50 μL의 수용액으로 실험하였다. 공진 주파수에서 포도당 수용액과 염화나트륨 수용액의 투과계수(S21)를 측정한 결과, 100 mg/dL 농도 변화 대비 각각 −0.06 dB, 0.14 dB 변하는 것을 확인하였고, 상반된 경향을 통해 두 수용액의 농도에 따른 S21의 변화를 선택적으로 구별하였다.
Abstract
In this work, glucose solution and sodium chloride solution were distinguished noninvasively using a microwave complementary split-ring resonator (CSRR). Based on the electrical properties of the two solutions measured using a open-ended coaxial probe, a CSRR was designed and fabricated for operation at a specific frequency that facilitates differentiating the two solutions. Furthermore, a polydimethylsiloxane mold was fabricated to concentrate the solution at a region where the electric field of the resonator was strongest, and a laminating film was used to prevent contact between the solution and resonator. Experiments were performed by dropping 50 μL of the solution in steps of 100 mg/dL up to a maximum human blood glucose level of 400 mg/dL. Our experiments confirmed that the transmission coefficients (S21) of glucose solution and sodium chloride solution exhibit variations of −0.06 dB and 0.14 dB, respectively, per 100 mg/dL concentration change at the resonance frequency. Thus, the opposite trends in the variation of S21 with change in the concentration of the two solutions can be used to distinguish between them.
Keywords: Complimentary Split Ring Resonator; Glucose; Sodium Chloride; Non-Invasive; Discrimination; Microwave Sensor
Ⅰ. 서 론
국제 당뇨병 연맹에 의하면, 2015년에 전 세계에서 약 40억 명의 당뇨병 환자가 확인되었고, 매년 증가하는 추세를 보여 2045년에는 약 70억 명의 당뇨병 환자가 집계될 것이라고 예상한다[1]. 혈당 농도가 높은 상태로 유지되면 신부전증, 안구질환, 심장마비, 뇌졸중 등 합병증을 동반하기 때문에 당뇨병은 전 세계적으로 중요한 건강 문제가 되고 있다[2]. 당뇨병 환자들은 혈당 농도를 정상 범위 내로 유지하기 위해 수시로 혈당 농도를 확인해야 하는데, 이 경우 흔히 사용하는 혈당 센서는 바늘로 직접 채혈하여 혈당 농도를 측정하는 방식을 사용한다[3]. 하지만 이 방식은 환자들에게 고통과 불편함을 줄 뿐만 아니라, 2차 감염의 위험도 존재한다[4]. 또한 센서는 가격이 비싸고, 검출하는데 사용되는 바늘과 띠는 일회용이기 때문에 하루에도 혈당 농도를 여러번 측정해야 하는 환자들은 비용에 대한 부담도 가진다[5]. 경제적 부담을 보완하기 위하여 쉽고 저렴한 제작과 재사용이 가능한 마이크로파 소자를 이용한 혈당 센서가 연구되었다[6]~[8]. 하지만 이러한 방식들은 소자와 혈액이 직접 닿게 하여 검출하는 방식으로, 여전히 채혈의 한계를 가진다. 따라서 최근 비침습적으로 혈당 농도를 검출하는 센서가 요구되고 있다.
광 방식과 마이크로파 방식은 매질을 침투하는 특성을 가지기 때문에 혈당 농도의 비침습적 검출이 가능하다. 그러나 광 방식은 외부 빛에 의한 영향이 크고 파장이 매우 짧아 민감도에 한계가 있으며 제작비용이 크게 발생한다. 한편, 마이크로파 방식은 상대적으로 작은 크기와 적은 비용으로 제작할 수 있으며 침투 깊이가 길기 때문에 비침습적 검출에 유리하다. 이에 마이크로파 방식은 혈당 센서[9], 습도 센서[10], 생체 분자 센서[11]~[13], 가스 센서[14],[15], 손목 맥박 센서[16]~[18], 생체 신호 센서[19]~[21], 유방암 센서[22],[23] 등 다양한 센서에 이용되고 있다.
사람의 혈액은 45 %의 혈구와 55 %의 혈장으로 구성되어 있으며, 혈장은 대부분의 물로 이루어져 있고, 이 밖에 알부민, 글로불린과 같은 단백질과 나트륨, 칼륨과 같은 무기질과 포도당 등으로 구성되어 있다. 혈장의 구성 성분 중에서 포도당과 나트륨은 식사 전후 농도가 각각 90 mg/dL에서 140 mg/dL로, 310 mg/dL에서 370 mg/dL로 가장 농도가 많이 증가하는 성분들이며, 당뇨병 환자들은 식사 직후 혈중 포도당 농도가 400 mg/dL까지 증가한다[24].
이에 본 연구에서는 마이크로파 대역에서 동작하는 공진기를 기반으로 하여 0 mg/dL에서 400 mg/dL까지 5단계의 농도 수준(0, 100, 200, 300, 400 mg/dL)에서 포도당 수용액과 염화나트륨 수용액을 비침습적으로 구별하는 센서를 제안하였다.
Ⅱ. 혈당 센서 설계
2-1 수용액의 전기적 특성 측정
포도당 수용액과 염화나트륨 수용액을 구별하는 센서를 설계하기에 앞서, 그림 1과 같이 개방형 동축 유전율 프로브(85070D)와 네트워크 분석기(E8364A)를 사용하여 구별하려는 두 수용액의 농도별 전기적 특성을 확인하였다.
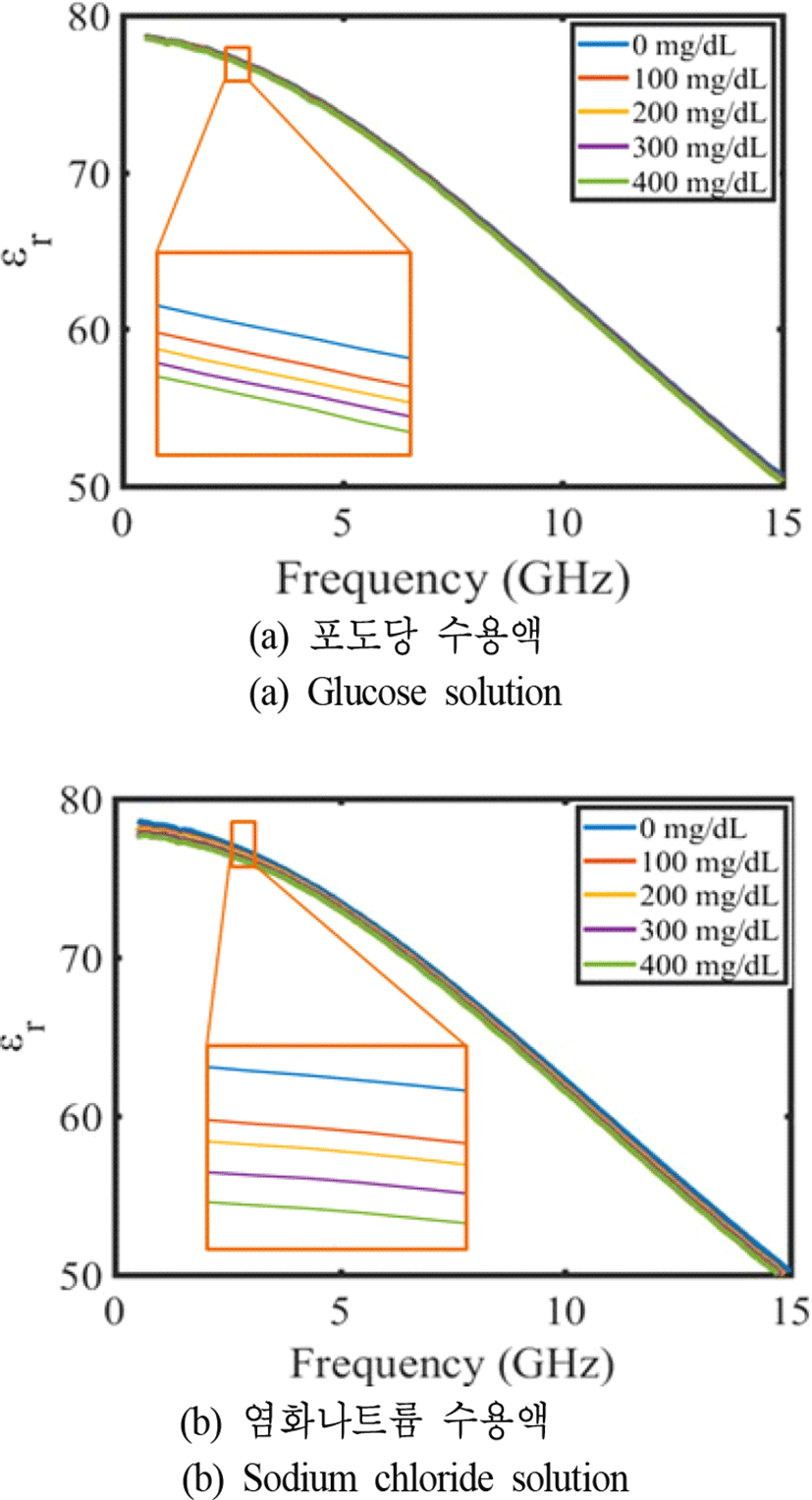
500 MHz~15 GHz의 주파수 범위에서 두 수용액의 유전율을 측정하였으며, 포도당 수용액의 농도는 사람의 혈중 포도당 범위인 400 mg/dL까지 100 mg/dL 단위로 측정하였다. 그리고 두 수용액의 비교를 위해 염화나트륨 수용액의 농도는 포도당 수용액의 농도와 같게 하였다. 포도당 수용액과 염화나트륨 수용액의 측정된 농도별 유전 상수를 그림 2에 나타내었다. 그래프에서 알 수 있듯이 포도당 수용액과 염화나트륨 수용액 모두 농도와 주파수가 증가함에 따라 유전 상수는 감소하는 경향을 보였다.
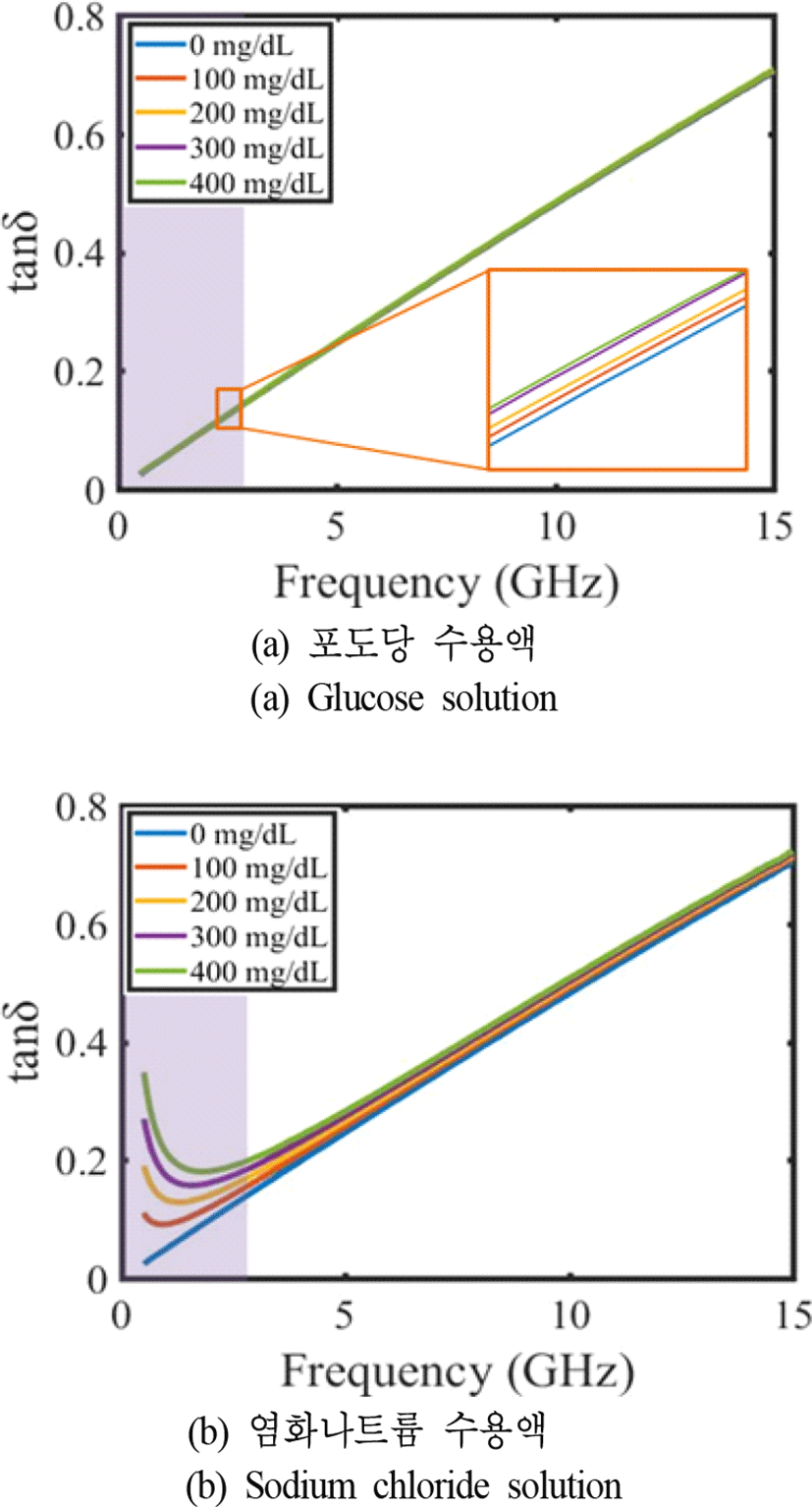
또한, 식 (1)의 유전율에서 유전 상수를 나타내는 실수부와 손실을 나타내는 허수부의 비로 정의되는 손실 탄젠트(식 (2))를 두 수용액에 대하여 그림 3에 나타내었다.
그림 3의 그래프에서 알 수 있는 것처럼 포도당 수용액과 염화나트륨 수용액 모두 농도와 주파수가 증가함에 따라 손실 탄젠트가 증가하는 경향을 보였다. 그러나 약 500 MHz~3 GHz의 대역에서는 두 수용액의 농도별 손실 탄젠트가 서로 다른 개형을 보였다. 따라서 본 논문에서는 포도당 수용액과 염화나트륨 수용액을 구별하기에 유리하며 공진기의 크기를 줄일 수 있는 2.5~3 GHz 대역을 센서의 동작 주파수 대역으로 정하였다.
2-2 공진기 및 환경 설계
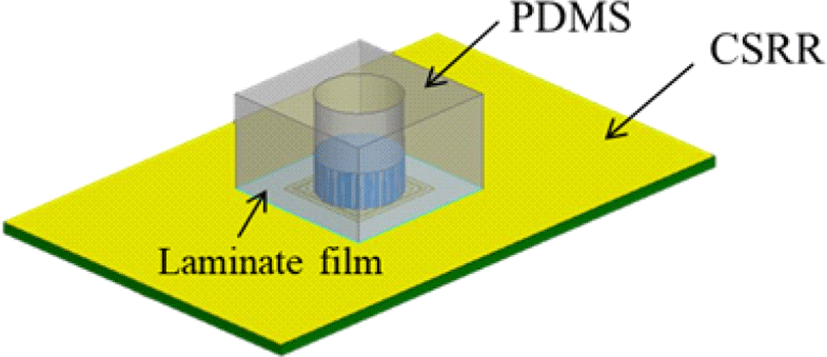
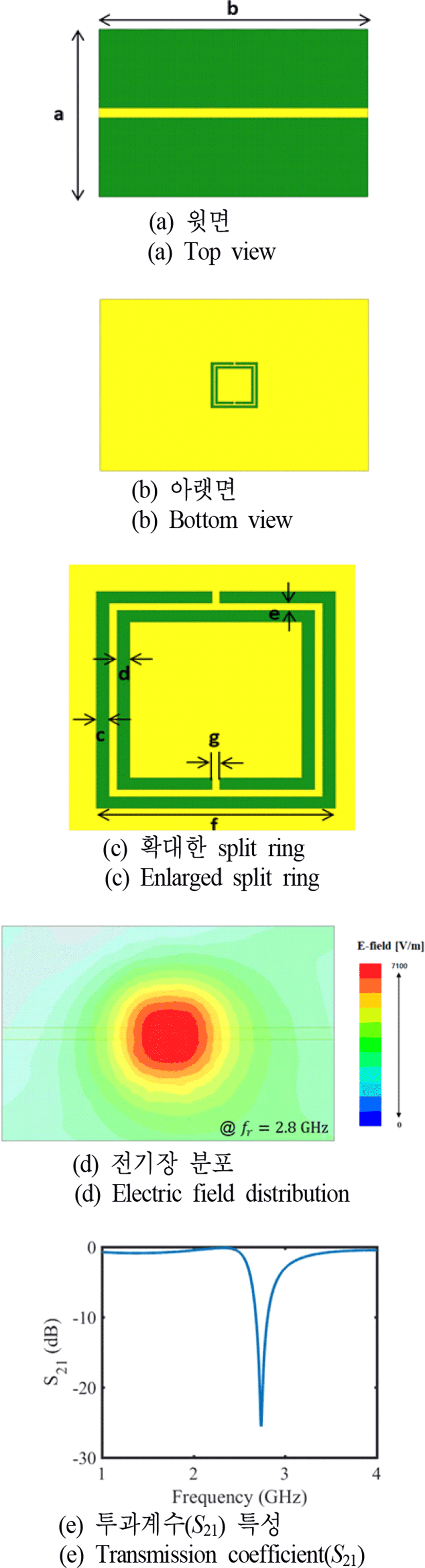
그림 4는 제안하는 혈당 센서의 전체 모습을 나타낸 것이다. 이 혈당 센서는 complementary split ring resonator (CSRR)를 기반으로 공진기에서 전기장이 가장 강하게 분포하는 부분에 수용액을 집중시키기 위한 PDMS mold, 공진기의 손상을 방지하며 수용액과 공진기의 직접적인 접촉을 막기 위한 라미네이트 필름으로 구성되어 있다.
마이크로파 공진기는 프린징 필드로 인해 근접장(near-field)이 형성되는데, 근접장 내에 다른 물체가 위치하게 되면 공진 주파수, 반사계수(reflection coefficient, S11), 투과계수(transmission coefficient, S21) 등 공진기의 특성이 변하게 된다. 이러한 공진기의 특성 변화로 수용액의 농도 변화를 검출할 수 있다.
공진기의 한 종류인 CSRR은 마이크로스트립의 접지 판을 split ring 형태로 에칭한 구조로, 전기 에너지와 자기 에너지가 같아지는 주파수에서 대역 저지 필터(band stop filter)의 특성을 가진다. CSRR은 전기적 커플링으로 공진기 주변에 프린징 필드가 많이 분포하여 유전율 변화를 잘 감지하는 장점을 가지기 때문에 물체의 유전율을 알아내는 연구가 많이 진행되었다[25],[26].
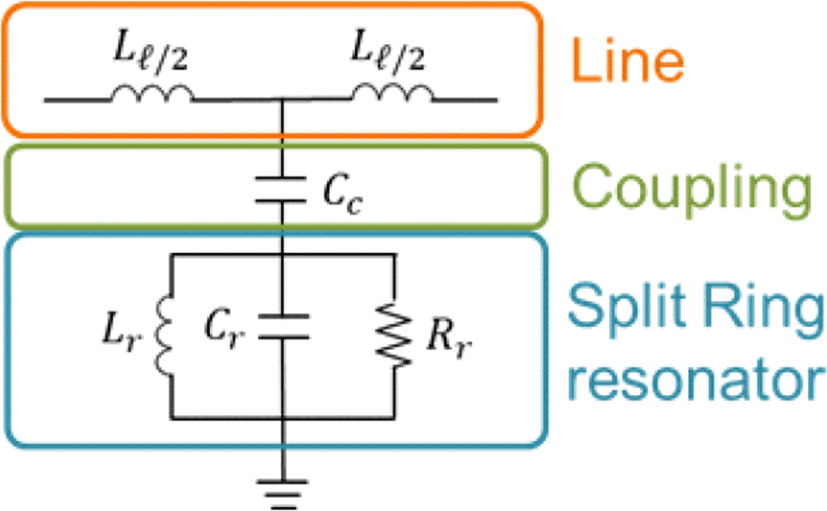
그림 5는 CSRR의 등가회로를 나타낸 것이다. Ll은 신호선의 인덕턴스, CC는 신호선과 split ring 사이의 결합 커패시터, Rr, Lr, Cr은 각각 split ring의 저항, 인덕턴스, 커패시턴스를 나타낸다.
또한, CSRR의 공진 주파수는 식 (3)과 같이 split ring의 인덕턴스와 커패시턴스, 신호선과 split ring 사이의 결합 커패시턴스에 의해 주로 결정된다[27]. 보통 인덕턴스는 수 nH 값을 가지고 커패시턴스는 수 pF 값을 가진다.
유전 상수가 2.17, 손실 탄젠트가 0.0008, 두께가 0.8 mm인 기판에 설계한 CSRR의 구조와 FDTD 기법으로 해석된 특성을 그림 6에 나타내었고, 공진기의 물리적 크기를 표 1에 정리하였다. 공진부에서 인덕턴스에 해당하는 라인의 길이(f)는 공진주파수에 지배적인 변수이고, 커패시턴스에 해당하는 간격(c, d, e, g)은 공진주파수와 임피던스 매칭을 결정하는 변수이다. 설계한 CSRR은 그림 6과 같이 split ring의 중앙에서 가장 전기장이 강하게 형성되며, 약 2.8 GHz에서 −26 dB의 S21 특성을 가진다.
표 1. | Table 1.
설계한 CSRR의 물리적 크기 | Dimensions of the designed CSRR.ParameterabcdefgValue [mm] 26400.390.380.2270.22
|
Parameter |
a |
b |
c |
d |
e |
f |
g |
|
Value [mm] |
26 |
40 |
0.39 |
0.38 |
0.22 |
7 |
0.22 |
Download Excel Table
PDMS는 polydimethylsiloxane으로, 유전 상수가 2.6, 손실 탄젠트가 0.001로 적은 손실을 갖는 물질이다[28]. 사용한 PDMS mold는 다음과 같은 과정으로 제작한다. 먼저 3D 프린터를 이용하여 제작할 모양을 고려한 틀을 출력한다. 그 뒤 실리콘 엘라스토머 베이스와 큐어링 에이전트를 10:1로 섞고, 진공 처리를 통해 기포를 완전히 제거하여 출력해놓은 틀에 붓는다. 마지막으로 100°C에서 45분 이상 경화시킨 후 틀에서 분리하고 라미네이트 필름과 붙인다.
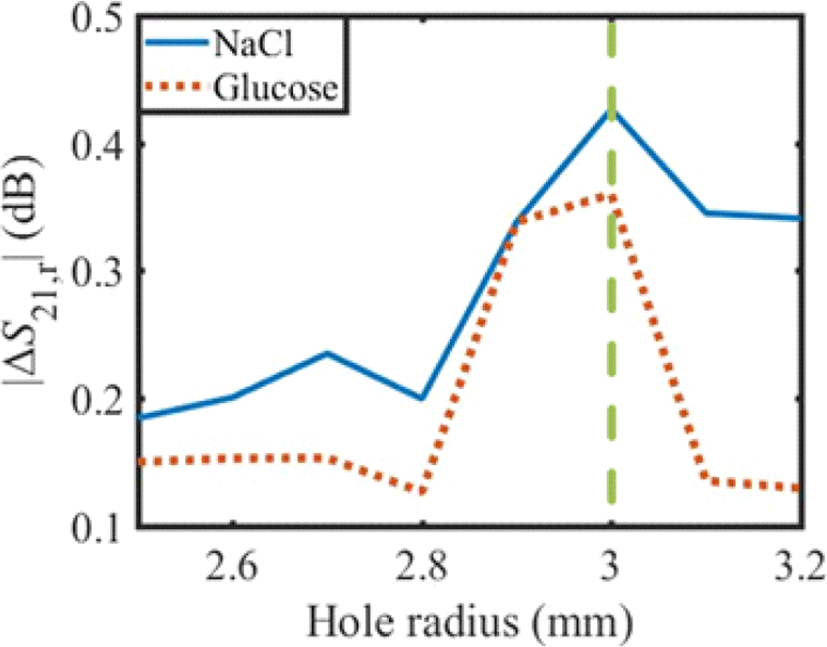
센서의 민감도를 개선하기 위하여 수용액이 위치하는 부분의 면적을 변화시키며 시뮬레이션하였다. PDMS mold의 구멍에 50 μL의 수용액을 위치시키고 구멍의 반지름을 2.5 mm부터 3.2 mm까지 0.1 mm 단위로 변화시킬 때 S21의 변화량을 관찰하여 그림 7에 나타내었다. ΔS21,r은 식 (4)와 같이 PDMS의 구멍이 각 반지름일 때 400 mg/dL의 수용액에 대한 S21을 탈이온수(0 mg/dL)에 대한 S21으로 정규화한 값이다. 시뮬레이션 결과 포도당 수용액과 염화나트륨 수용액 모두 반지름이 3 mm일 때 가장 큰 S21의 변화량을 보였다.
그림 7. | Fig. 7.
PDMS mold의 반지름 변화에 따른 투과계수(S21) 변화 | Variation of transmission coefficient(S21) versus the change of the radius of PDMS mold.
Download Original Figure
Ⅲ. 시뮬레이션 및 측정 결과
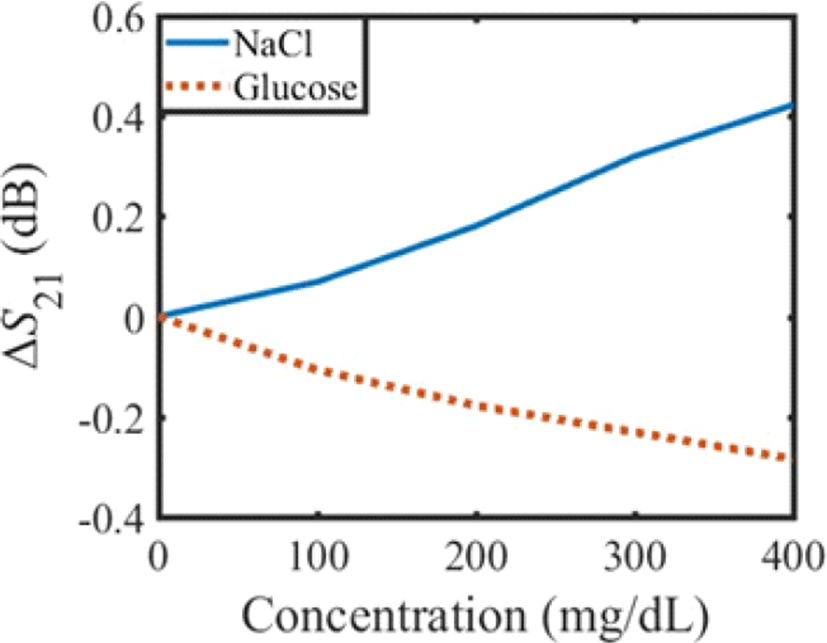
설계한 센서에 포도당 수용액과 염화나트륨 수용액을 위치시키고 농도를 변화시킬 때 공진 주파수에서의 S21 변화를 시뮬레이션하였다. 각 농도별 수용액의 유전 특성은 유전율 프로브로 측정된 유전 상수와 손실 탄젠트를 적용하였다. 수용액의 농도에 따른 시뮬레이션 결과를 그림 8에 나타내었다. ΔS21은 식 (5)와 같이 각 농도에서의 S21을 수용액의 농도가 0 mg/dL일 때의 S21으로 정규화한 값이다.
그림 8. | Fig. 8.
수용액의 농도에 따른 투과계수(S21) 변화 시뮬레이션 결과 | Simulation result of variation of transmission coefficient(S21) versus the change of concentration of solution.
Download Original Figure
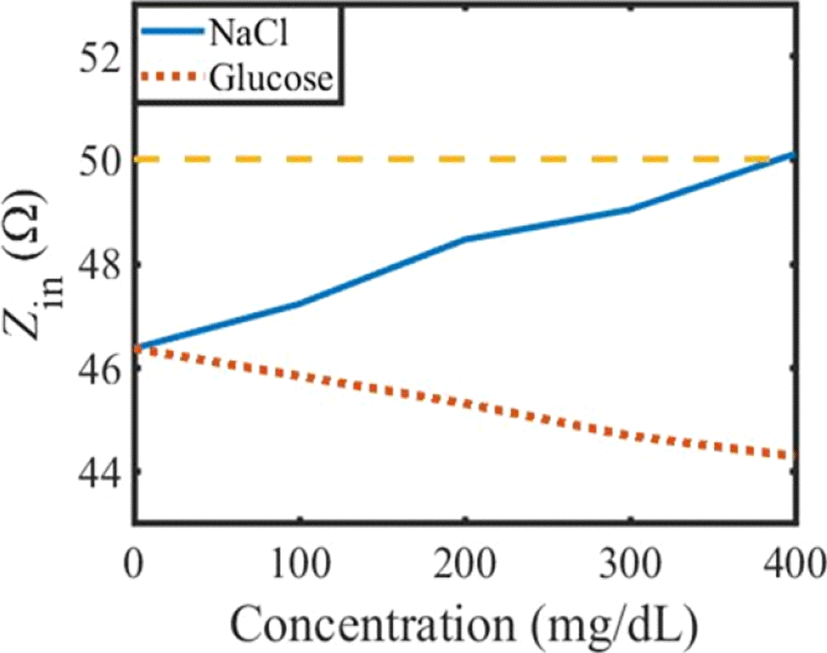
시뮬레이션 결과 그림 8과 같이 포도당 수용액과 염화 나트륨 수용액의 농도에 따른 S21의 변화가 상반된 경향을 보였다. 그림 9는 수용액을 농도별로 변화시켰을 때의공진기의 입력임피던스(Zin) 변화를 나타낸 것이다. 그림 9에서 포도당 수용액의 농도가 증가함에 따라 공진기의 Zin은 50 Ω에서 멀어지기 때문에 S11이 증가하고 S21이 감소한다. 반면에 염화나트륨 수용액의 농도가 증가함에 따라 Zin은 50 Ω에 가까워지기 때문에 포도당 수용액과 상반된 공진기의 특성 변화를 보인다.
그림 9. | Fig. 9.
수용액의 농도에 따른 공진기의 입력임피던스(Zin) 변화 | Variation of input impedance(Zin) of resonator versus the change of concentration of solution.
Download Original Figure
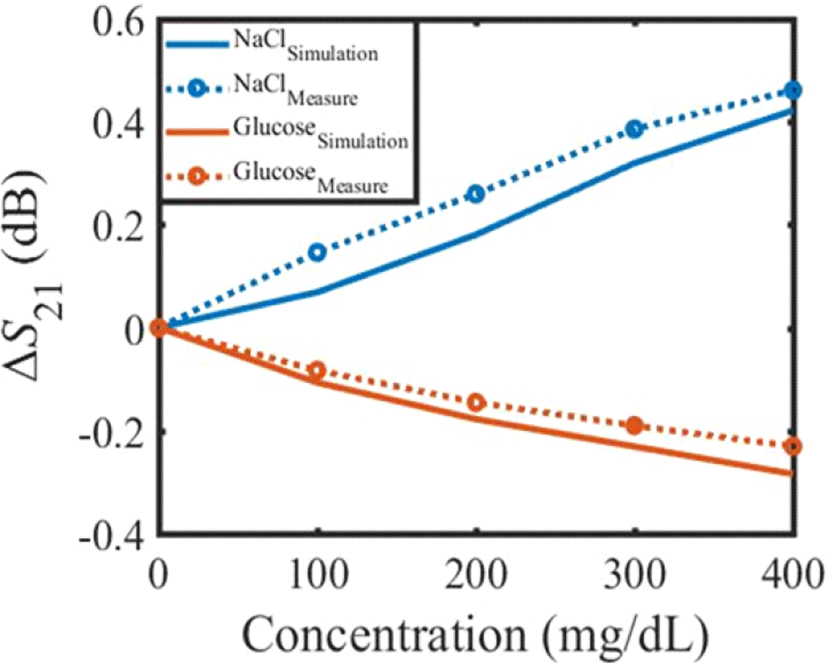
센서를 제작한 후 50 μL의 농도에 따른 수용액을 PDMS mold의 구멍에 떨어뜨리고 네트워크 분석기(E5071B)로 공진 주파수에서의 S21을 측정하였다. 그 결과를 시뮬레이션 결과와 함께 그림 10에 나타내었다. 실험 결과는 시뮬레이션과 같이 포도당 수용액의 경우와 염화나트륨 수용액의 경우에서 S21의 변화 경향이 상반된 결과를 보였다. 400 mg/dL 농도의 포도당 수용액과 NaCl 수용액에 대한 S21의 변화량은 시뮬레이션 결과 각각 약 −0.28 dB, 0.42 dB가 관찰되었다. 한편, 두 수용액의 측정 결과는 각각 약 −0.23 dB, 0.46 dB의 S21의 변화량이 측정되었다. 시뮬레이션과 측정치의 차이는 액체의 표면장력과 같은 화학적 성질이 시뮬레이션에 고려되지 않았고, PDMS mold 제작 및 부착 시 생긴 오차로 인해 발생하였다.
그림 10. | Fig. 10.
수용액의 농도에 따른 투과계수(S21) 변화 시뮬레이션 및 실험 결과 | Simulation and experimental result of variation of transmission coefficient(S21) versus the change of concentration of solution.
Download Original Figure
Ⅳ. 결 론
본 논문에서는 마이크로파 대역에서 포도당 수용액과 염화나트륨 수용액을 비침습적으로 구별하는 센서를 제안하였다. 공진기에 집중되는 프린징 필드로 인해 물질의 유전율 검출에 유리한 CSRR과 공진기의 전기장이 강하게 형성되는 부분에 수용액을 위치시키기 위한 PDMS mold, 공진기와 수용액의 직접적인 접촉을 막기 위한 라미네이트 필름으로 구성된 센서를 FDTD 기법의 상용툴을 이용하여 단계별로 시뮬레이션하여 최적화하였다. 그리고 설계된 센서를 제작하여 실제 인체에서 적용되는 농도 수준들(0, 100, 200, 300, 400 mg/dL)에 대한 50 μL의 포도당 수용액과 염화나트륨 수용액을 PDMS mold의 구멍에 떨어뜨리고 투과계수를 측정하였다. 그 결과, 포도당 수용액과 염화나트륨 수용액의 농도가 증가함에 S21 변화의 상반된 경향을 보여 실험적으로 센서로서의 가능성을 검증하였다.
Acknowledgements
이 논문은 2017년도 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업임(NRF-2017R1A2B2011724)
References
E. C. Green, “Design of a microwave sensor for non-invasive determination of blood-glucose concentration,” Ph. D. dissertation, Baylor University, Waco, TX, 2005.

H. Choi, S. Luzio, J. Beutler, and A. Porch, “Microwave noninvasive blood glucose monitoring sensor: Human clinical trial results,” in
2017 IEEE MTT-S International Microwave Symposium(IMS), Honololu, HI, 2017, pp. 876-879.

,

,


S. K. Vashist, “Non-invasive glucose monitoring technology in diabetes management: A review,”
Analytica Chimica Acta, vol. 750, pp. 16-27, 2012.

,


K. K. Adhikari, N. Y. Kim, “Ultrahigh-sensitivity mediator-free biosensor based on a microfabricated microwave resonator for the detection of micromolar glucose concentrations,”
IEEE Transactions on Microwave Theory and Techniques, vol. 64, no. 1, pp. 319-327, 2016.


H. Park, H. S. Yoon, U. Patil, R. Anoop, J. Lee, and J. Lim, et al., “Radio frequency based label-free detection of glucose,”
Biosensors and Bioelectronics, vol. 54, pp. 141-145, 2014.

,


N. Y. Kim, R. Dhakal, K. K. Adhikari, E. S. Kim, and C. Wang, “A reusable robust radio frequency biosensor using microwave resonator by integrated passive device technology for quantitative detection of glucose level,”
Biosensors and Bioelectronics, vol. 67, pp. 687-693, 2015.

,


윤기호, “귓불에서 비침습 혈당관찰을 위한 슬롯결합 커패시터 공진기 연구,” 한국전자파학회논문지, 28(4), pp. 279-285, 2017년 4월.


J. K. Park, T. G. Kang, B. H. Kim, H. J. Lee, H. H. Choi, and J. G Yook, “Real-time humidity sensor based on microwave resonator coupled with PEDOT: PSS conducting polymer film,”
Scientific Reports, vol. 8, no. 1, pp. 439, 2018.

,

,


H. J. Lee, J. H. Lee, S. Choi, I. S. Jang, J. S. Choi, and H. I. Jung, “Asymmetric split-ring resonator-based biosensor for detection of label-free stress biomarkers,”
Applied Physics Letters, vol. 103, p. 053702, Jul. 2013.


S. G. Kim, H. J. Lee, J. H. Lee, H. I. Jung, and J. G. Yook, “A highly sensitive and label free biosensing platform for wireless sensor node system,”
Biosensors and Bioelectronics, vol. 50, pp. 362-367, Dec. 2013.

,


Y. Hong, H. J. Lee, S. G. Kim, B. H. Kim, G. H. Yun, and J. G. Yook, “A label-free biosensing platform using a PLL circuit and biotin-streptavidin binding system,”
IEEE Transactions on Biomedical Circuits and Systems, vol. 9, no. 3, pp. 345-352, 2015.

,


G. Bailly, A. Harrabi, J. Rossignol, D. Stuerga, and P. Pribetich, “Microwave gas sensing with a microstrip interDigital capacitor: Detection of NH3 with TiO2 nanoparticles,”
Sensors and Actuators B: Chemical, vol. 236, pp. 554-564, Nov. 2016.


B. H. Kim, Y. J. Lee, H. J. Lee, Y. Hong, J. G. Yook, and M. H. Chung, et al., “A gas sensor using double split-ring resonator coated with conducting polymer at microwave frequncies,” in
IEEE Sensors 2014 Proceedings, Valencia, 2014, pp. 1815-1818.

,


Y. J. An, G. H. Yun, S. W. Kim, and J. G. Yook, “Wrist pulse detection system based on changes in the near-field reflection coefficient of a resonator,”
IEEE Microwave and Wireless Components Letters, vol. 24, no. 10, pp. 719-721, 2014.


Y. J. An, B. H. Kim, G. H. Yun, S. W. Kim, S. B. Hong, and J. G. Yook, “Flexible non-constrained RF wrist pulse detection sensor based on array resonators,”
IEEE Transactions on Biomedical Circuits and Systems, vol. 10, no. 2, pp. 300-308, 2016.

,


B. H. Kim, Y. Hong, Y. J. An, S. G. Kim, H. J. Lee, and S. W. Kim, et al., “A proximity coupling RF sensor for wrist pulse detection based on injection-locked PLL,”
IEEE Transactions on Microwave Theory and Techniques, vol. 64, no. 5, pp. 1667-1676, 2016.


S. G. Kim, G. H. Yun, and J. G. Yook, “Compact vital signal sensor using oscillation frequency deviation,”
IEEE Transactions on Microwave Theory and Techniques, vol. 60, no. 2, pp. 393-400, 2012.


Y. Hong, S. G. Kim, B. H. Kim, S. J. Ha, H. J. Lee, and G. H. Yun, et al., “Noncontact proximity vital sign sensor based on PLL for sensitivity enhancement,”
IEEE Transactions on Biomedical Circuits and Systems, vol. 8, no. 4, pp. 584-593, 2014.

,


Y. An, G. Yun, and J. Yook, “Sensitivity enhanced vital sign detection based on antenna reflection coefficient variation,”
IEEE Transactions on Biomedical Circuits and Systems, vol. 10, no. 2, pp. 319-327, 2016.

,


S. M. Aguilar, M. A. Al-Joumayly, M. J. Burfeindt, N. Behdad, and S. C. Hagness, “Multiband miniaturized patch antennas for a compact, shielded microwave breast imaging array,”
IEEE Transactions on Antennas and Propagation, vol. 62, no. 3, pp. 1221-1231, 2014.

,

,


W. Huang, A. A. Kishk, “Compact dielectric resonator antenna for microwave breast cancer detection,”
IET Microwaves, Antennas & Propagation, vol. 3, no. 4, pp. 638-644, 2009.


E. Topsakal, T. Karacolak, and E. C. Moreland, “Glucose-dependent dielectric properties of blood plasma,” in
2011 XXXth URSI General Assembly and Scientific Symposium, Istanbul, 2011, pp. 1-4.


C. S. Lee, C. L. Yang, “Complementary split-ring resonators for measuring dielectric constants and loss tangents,”
IEEE Microwave and Wireless Components Letters, vol. 24, no. 8, pp. 563-565, 2014.


M. S. Boybay, O. M. Ramahi, “Material characterization using complementary split-ring resonators,”
IEEE Transactions on Instrumentation and Measurement, vol. 61, no. 11, pp. 3039-3046, 2012.


A. Ebrahimi, W. Withayachumnankul, S. F. Al-Sarawi, and D. Abbott, “Dual-mode behavior of the complementary electric-LC resonators loaded on transmission line: Analysis and applications,”
Journal of Applied Physics, vol. 116, no. 8, 2014.


H. J. Lee, J. G. Yook, “Droplet sensing using small and compact high-Q planar resonator based on impedance matching technique,”
Review of Scientific Instruments, vol. 87, p. 094706, Sep. 2016.

,